Die Medien sind voll mit Meldungen zum erfolgreichen Einsatz künstlicher Intelligenz in der Medizin. Aber was können intelligente Algorithmen wirklich leisten? Wo ist ihr Einsatz in der Krebsdiagnostik und -therapie sinnvoll? Welche Probleme sind damit verbunden? krebsinformationsdienst.med informiert Sie über die Hintergründe.
KI, Maschinelles Lernen und Co.
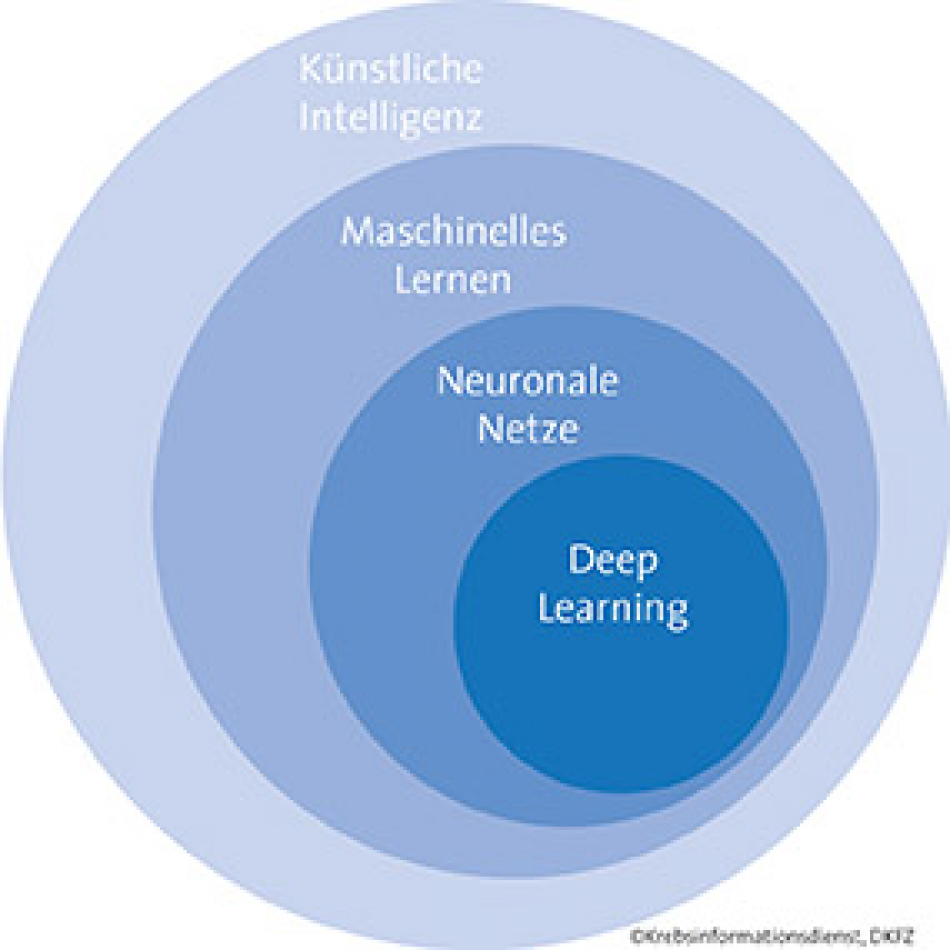
Die Fortschritte in der Entwicklung künstlicher Intelligenz (KI) sind vor allem auf die Entwicklung komplexer maschineller Lernverfahren zurückzuführen: Neuronale Netze trainieren sich bestimmte Fähigkeiten an, die sie dann auf neue, unbekannte Daten derselben Art anwenden. Wichtige Begriffe rund um das Thema KI siehe Infobox.
KI in der Diagnostik
Künstliche Intelligenz (KI)/Artificial Intelligence (AI): Sammelbegriff für die Fähigkeit von Programmen und Maschinen, Aufgaben zu bewältigen, die normalerweise ein hohes Maß an menschlicher Intelligenz erfordern.
Maschinelles Lernen: Teilgebiet der KI, das sich mit Algorithmen und Verfahren befasst, die mithilfe verschiedener Lernmethoden aus vielen Beispielsfällen Muster und Regeln ableiten. Das Gelernte wenden sie dann auf neue Entscheidungsfälle an.
Künstliche neuronale Netze: Informationsverarbeitende Systeme, die zum maschinellen Lernen eingesetzt werden. Sie bestehen aus vielen einzelnen Einheiten ("Neuronen"), die Informationen aufnehmen und verarbeiten. Neuronale Netze sind meist in Schichten aufgebaut: Zwischen der Eingangs- und der Ausgangsschicht können sich zahlreiche Zwischenschichten befinden.
Tiefe neuronale Netze/Deep Learning: Die Komplexität eines Netzes, seine "Tiefe", wird von der Zahl der Neuronen, der Zahl der Schichten und den Verbindungen zwischen den einzelnen Neuronen bestimmt. Das Lernen in neuronalen Netzen mit sehr vielen Zwischenschichten wird als Deep Learning bezeichnet.
Überall dort, wo es um die Analyse von Bildern geht, seien es Röntgenbilder, Fotos oder Videosequenzen, ist die Entwicklung selbstlernender Algorithmen weit fortgeschritten. Deep-Learning-Systeme werden unter anderem in der Radiologie, der Pathologie, der Augenheilkunde und der Dermatologie erfolgreich eingesetzt. Mithilfe tiefer neuronaler Netzwerke werden beispielsweise Lungenerkrankungen im CT, Brustkrebszellen in histologischen Schnittbildern, diabetische Netzhautveränderungen oder maligne Melanome zuverlässig erkannt.
Zuverlässig und schneller? Nach den Ergebnissen einer aktuellen Metaanalyse1 diagnostizieren einzelne KI-Systeme Krankheiten auf der Basis von Bilddaten so zuverlässig wie Ärzte. Allerdings ist die Datenlage sehr dünn und die Aussagekraft der meisten Studien gering.
Ob die diagnostischen Fähigkeiten der Maschine denen des Arztes in der klinischen Praxis gleichwertig sind, scheint damit nicht zweifelsfrei bewiesen. Großer Vorteil der KI ist jedoch die Geschwindigkeit, mit der sie Bilddaten ermüdungsfrei analysiert. Dies allein ist bei der steigenden Zahl von Bildern im Rahmen moderner Diagnostik interessant.
Zusatzinformationen durch KI? Letztlich verbindet sich mit Einsatz intelligenter selbstlernender Systeme die Hoffnung, dass die KI Zusammenhänge erkennt, die für das menschliche Auge nicht sichtbar sind. So erhofft man sich zum Beispiel allein auf Grund der Bilddaten Informationen über Genveränderungen, den Krankheitsverlauf oder das Ansprechen auf bestimmte Medikamente. Auf diese Weise könnte KI die Diagnostik nicht nur automatisieren und beschleunigen, sondern würde auch zu einem echten Informationsgewinn mit möglichen Implikationen für die Therapie führen.
Nutzen für den Patienten? Einzelne KI-Modelle können beispielsweise genomische Veränderungen bereits an Routinebildern erkennen. So ließ sich eine Mikrosatelliteninstabilität bei gastrointestinalen Tumoren allein auf Grund des histopathologischen Bildes vorhersagen2. Auch bestimmte Mutationen bei zerebralen Gliomen wurden anhand von MRT-Bildern durch ein entsprechend trainiertes neuronales Netz erkannt3 – entscheidende Informationen für die Therapie, die ansonsten zusätzliche Diagnostik erfordern.
Klinische Studien müssen nun untersuchen, ob solche Informationen dem Patienten tatsächlich nutzen und die Patientenversorgung verbessern.
Integration von Big Data? Perspektivisch könnten mit Methoden des maschinellen Lernens viele gesundheitsrelevante Daten verknüpft und ausgewertet werden: Bilddaten könnten mit klinischen, laborchemischen, genetischen und statistischen Daten korreliert werden, um den individuellen Krankheitsverlauf vorherzusagen und die Behandlung besser auf den einzelnen Patienten abzustimmen. Daten von Wearables und aus Social Media könnten ebenfalls berücksichtigt werden. Die Medizin würde sich so mithilfe von Big Data von einer standardisierten zu einer stärker personalisierten Medizin wandeln. Bis dahin ist es jedoch noch ein weiter Weg.
Weitere Einsatzbereiche
Künstliche Intelligenz kann nicht nur in der Diagnostik, sondern auch in vielen anderen Bereichen der Gesundheitsversorgung eingesetzt werden. Um nur einige Anwendungsbeispiele zu nennen:
Patientenversorgung: KI kann beispielsweise Chirurgen durch Echtzeitanalyse des Operationssitus auf kritische anatomische Strukturen hinweisen, Patienten mit beginnender Sepsis überwachen oder vorhersagen, welche Intensivpatienten sicher auf Normalstation verlegt werden können. Mit Hilfe von KI lassen sich Patientendaten verwalten, Arbeitsabläufe optimieren und damit Effizienz und Patientensicherheit steigern. Zukünftig könnten Chatbots Routinegespräche übernehmen und Ärzte entlasten.
Forschung: In der Forschung kann KI helfen, Biomarker für bestimmte Krankheiten aufzudecken, geeignete Kandidaten für neue Medikamente zu finden und klinische Studien zu beschleunigen.
Verwaltung: Mithilfe von KI lassen sich auch in der Verwaltung Abläufe analysieren und optimieren und beispielsweise die Termin- und Personalplanung entsprechend anpassen.
Probleme, Grenzen, Herausforderungen
Es wird erwartet, dass künstliche Intelligenz in den nächsten Jahren zunehmend in allen Bereichen des Gesundheitswesens eingesetzt wird. Vor einem breiten Einsatz sind jedoch noch verschiedene Fragen rund um das Thema KI zu klären:
Generalisierbarkeit des Ausgangsdatensatzes: Da neuronale Netze aus den Eingabedaten lernen, sind umfangreiche, qualitativ hochwertige und ausgewogene Datensätze für die Entwicklung aussagekräftiger KI-Modelle entscheidend. Nur wenn die Daten repräsentativ sind, lässt sich das Gelernte verallgemeinern und auf andere, neue Daten übertragen. Umfangreiche Datensätze sind jedoch auch wegen datenschutzrechtlicher Vorgaben Mangelware.
Evaluation unter klinischen Bedingungen: Die KI hat in vielen Bereichen den Praxistest noch nicht bestanden. Häufig sind die Datensätze nicht extern validiert und es fehlt der Beweis, dass die KI auch unter klinischen Bedingungen funktioniert. Es ist auch nicht geklärt, ob eine Therapieentscheidung, die auf einer nachgewiesenen Korrelation zwischen verschiedenen medizinischen Daten beruht, dem einzelnen Patienten wirklich nutzt und keine unvertretbaren Risiken in sich birgt. Prospektive Studien unter klinischen Bedingungen zu klinisch relevanten Fragestellungen stehen in den meisten Fällen noch aus.
Nachvollziehbarkeit, Erklärbarkeit, Transparenz: Viele KI-Systeme sind sogenannte Black-Box-Systeme, das heißt, ihre Entscheidungsgrundlage ist nicht nachvollziehbar. Das ist nicht so wichtig bei Diagnosen und Entscheidungen, die der Arzt selbst überprüfen kann. In anderen Bereichen ist die Black Box jedoch ein Problem für die Interpretierbarkeit und Vertrauenswürdigkeit des Systems. Außerdem darf nach europäischem Datenrecht niemand einer Entscheidung unterworfen werden, die ausschließlich auf automatisierter Datenverarbeitung beruht. KI-basierte Entscheidungen müssen dem Betroffenen transparent und leicht verständlich erklärt werden. Daher werden derzeit Systeme entwickelt, deren Entscheidungen besser nachvollziehbar sind ("transparente/erklärbare KI").
Datensicherheit und Datenherrschaft: Bei der Entwicklung und bei der Anwendung von KI-Systemen fallen sensible personenbezogene Daten an, die besonders zu schützen sind. Ungeklärt ist, wie und ob Gesundheitsdaten genutzt werden dürfen, um KI-Systeme zu trainieren, beziehungsweise wem die Rechte an den medizinischen Daten und ihren Verarbeitungsergebnissen zustehen.
Reichweite von Fehlern, Haftung: Die potenzielle Reichweite systematischer Fehler durch einen fehlerhaften Algorithmus ist ungleich größer als die Reichweite individueller Fehler eines einzelnen Arztes. Bisher ist ungeklärt, wer letzten Endes für eine fehlerhafte KI haftet: der Entwickler oder der anwendende Arzt.
Kosteneffizienz: Der verstärkte Einsatz von KI im Gesundheitswesen wird unter anderem mit einer höheren Kosteneffizienz gerechtfertigt. Da die Kosten für Infrastruktur, Betrieb und Wartung bisher nur geschätzt werden können, steht auch hier der Beweis noch aus, dass KI-Systeme tatsächlich kosteneffizient sind.
Fazit
Künstliche Intelligenz wird überall dort eingesetzt, wo große Datenmengen in kurzer Zeit verarbeitet werden müssen. Sie kann so den Arzt bei der Diagnose unterstützen, bei der Priorisierung helfen und die Zeit bis zum Beginn der Therapie verkürzen. KI kann Arbeitsabläufe optimieren und die Patientensicherheit verbessern.
Trotz der vielen Erfolgsmeldungen sind die Fähigkeiten der KI bisher auf eng umschriebene Aufgaben begrenzt. Es fehlen prospektive klinische Studien, die zeigen, dass die KI unter klinischen Bedingungen zuverlässig arbeitet und die Patientenversorgung verbessert. Viele Fragen sind weiterhin offen, unter anderem Fragen zu Datenschutz, Eigentumsrechten und Haftung bei Fehlern.
Zum Weiterlesen: Verwendete Quellen und vertiefende Informationen
1 Liu X, Faes L, Kale AU, Wagner SK, Fu DJ, Brynseels A, Mahendiran T, Moraes G, Shamdas M, Kern C et al. A comparison of deep learning performance against health-care professionals in detecting diseases from medical imaging: a systematic review and meta-analysis. Lancet Digital Health. 2019 Oct; 1:e271-97. doi:https://doi.org/10.1016/S2589-7500(19)30123-2.
2 Kather JN, Pearson AT, Halama N, Jäger D, Krause J, Loosen SH, Marx A, Boor P, Tacke F, Neumann UP et al. Deep learning can predict microsatellite instability directly from histology in gastrointestinal cancer. Nat Med. 2019 Jul;25(7):1054-1056. doi: 10.1038/s41591-019-0462-y.
3 Chang P, Grinband J, Weinberg BD, Bardis M, Khy M, Cadena G, Su MY, Cha S, Filippi CG, Bota D, Baldi P et al. Deep-Learning Convolutional Neural Networks Accurately Classify Genetic Mutations in Gliomas. AJNR Am J Neuroradiol. 2018 Jul;39(7):1201-1207. doi: 10.3174/ajnr.A5667.
Weitere Übersichtsarbeiten und Fachveröffentlichungen
Einen Überblick über den Einsatz von künstlicher Intelligenz in der Medizin geben unter anderem folgende Artikel in englischer Sprache:
Rajkomar A, Dean J, Kohane I. Machine Learning in Medicine. N Engl J Med. 2019 Apr;380(14): 1347-1358. doi: 10.1056/NEJMra1814259.
Topol EJ. High-performance medicine: the convergence of human and artificial intelligence. Nat Med. 2019 Jan;25(1):44-56. doi: 10.1038/s41591-018-0300-7.
Rechtlicher Rahmen/Behördeninformationen
Europäische Datenschutz-Grundverordnung zur automatisierten Entscheidungsfindung:
Datenschutz-Grundverordnung (Verordnung (EU) 2016/679 des Europäischen Parlaments und des Rates vom 27. April 2016 zum Schutz natürlicher Personen bei der Verarbeitung personenbezogener Daten, zum freien Datenverkehr und zur Aufhebung der Richtlinie 95/46/EG). In Geltung seit dem 25.05.2018. https://eur-lex.europa.eu/legal-content/DE/TXT/PDF/?uri=CELEX:32016R0679&from=DE.
Bundesdatenschutzgesetz. § 27 Datenverarbeitung zu wissenschaftlichen oder historischen Forschungszwecken und zu statistischen Zwecken. www.gesetze-im-internet.de/bdsg_2018/
krebsinformationsdienst.med: Service für Fachkreise
aktuell – evidenzbasiert – unabhängig
Sie sind beruflich an der Versorgung von Krebspatienten beteiligt und haben Fragen? Mit dem Angebot krebsinformationsdienst.med unterstützt Sie der Krebsinformationsdienst bei Ihrer Arbeit, mit unabhängigen, aktuellen und qualitätsgesicherten Informationen. krebsinformationsdienst.med steht Ihnen von Montag bis Freitag zur Verfügung:
- telefonisch von 8.00 bis 20.00 Uhr unter der kostenfreien Rufnummer 0800 – 430 40 50
- per E-Mail an kid.med@dkfz.de, bei einem Klick öffnet sich ein Kontaktformular für eine sichere Verbindung
Sie suchen nach verlässlichen Recherchequellen zu onkologischen Themen? Im Ressourcen-Center finden Sie kommentierte Links zu epidemiologischen Daten, Arzneimittelinformationen, evidenzbasierter Medizin, Risikofaktoren und Studienregistern.