Immuntherapie gegen Krebs: Impfungen, Antikörper, neue Wirkstoffe
Kann man die körpereigene Abwehr zur Krebsbehandlung nutzen?
Hinter dem Begriff "Immuntherapie" können sich sehr unterschiedliche Ansätze verbergen. Was versteht man unter einer Krebs-Impfung? Was bewirken Antikörper? Was sind Checkpoint-Inhibitoren? Der folgende Text bietet einen Überblick über verschiedene Verfahren, die das körpereigene Immunsystem nutzen, um Krebs zu bekämpfen. Nur wenige Immuntherapien sind bereits zur Behandlung von Krebspatienten zugelassen. Weitere werden aber intensiv in der Grundlagenforschung und in klinischen Studien geprüft. Betroffene und ihre Angehörigen erfahren in diesem Text, für wen eine Immuntherapie infrage kommt und was man sich davon erwarten kann. Interessierte und Fachkreise finden Hinweise auf weiterführende Informationen und genutzte Quellen. Wichtig für Betroffene: Eine ärztliche Beratung lässt sich durch Informationen aus dem Internet jedoch nicht ersetzen.
Immuntherapie gegen Krebs: Wichtiges in Kürze
Als Immuntherapien werden alle Methoden bezeichnet, die das körpereigene Immunsystem nutzen, um Krebs zu bekämpfen. Dafür kommen ganz unterschiedliche Ansätze infrage. Was ihnen gemeinsam ist: Schon bestehende Abwehrmechanismen des Körpers werden verstärkt und gezielt auf die Krebszellen gerichtet.
Grundsätzlich kann das Immunsystem Tumorzellen durchaus erkennen und vernichten. Voraussetzung ist aber: Sie müssen deutliche Veränderungen im Vergleich zu gesundem Gewebe tragen. Nicht alle Krebszellen zeigen solche eindeutigen Merkmale. Und: Tumorzellen verändern sich ständig weiter. Sie können außerdem Ausweichstrategien gegen eine Immunantwort entwickeln: zum Beispiel, indem sie sich "unsichtbar" für das Immunsystem machen. Oder indem sie die Immunreaktion hemmen. So können sie der Immunabwehr entkommen.
- Eine allgemeine, ungezielte Stärkung des Immunsystems reicht daher zur Krebsbekämpfung in der Regel nicht aus.
- Krebs-Immuntherapien zielen dagegen darauf ab, die Ausweichstrategien der Krebszellen gezielt zu umgehen und die körpereigene Abwehr direkt auf die Krebszellen zu lenken.
Welche Medikamente gibt es bereits?
Bisher gibt es allerdings nur wenige nachgewiesene wirksame und zugelassene Medikamente. Sie werden bisher nur bei manchen Tumorarten und überwiegend für Betroffene mit fortgeschrittener Erkrankung eingesetzt. Viele weitere Therapieansätze werden in der Grundlagenforschung oder in klinischen Studien geprüft, darunter auch Tumorimpfungen. Einige sind vielversprechend, müssen aber noch weiter getestet werden, bevor sie in der klinischen Routine zum Einsatz kommen können.
Warum hört man dann trotzdem so viel von "Immunstärkung gegen Krebs"? Es gibt eine ganze Reihe von Anbietern, die ihren Patientinnen und Patienten Erfolge mit ihren selbst entwickelten Immuntherapien versprechen. Schaut man genauer hin, handelt es sich zum Beispiel um Mittel zur angeblichen "Immunstärkung", deren Erfolg nicht einmal gegen Erkältungsviren belegt ist. Viele Anbieter bewerben Krebsimpfungen und andere Immuntherapien ohne bewiesene Wirkung und bieten sie außerhalb von klinischen Studien an. Fachleute sehen diesen Einsatz kritisch: Sie schließen Nachteile und mögliche Risiken nicht aus. Und: Viele solcher Angebote sind sehr teuer. Weil ihr Nutzen nicht belegt ist, muss man sie fast immer selbst zahlen.
Zählen Antikörper auch zur Immuntherapie?
Medikamente mit Antikörpern spielen schon seit einigen Jahren eine große Rolle in der Krebstherapie. Prinzipiell könnte man sie zwar auch als Immuntherapie bezeichnen, denn normalerweise werden Antikörper von Immunzellen hergestellt. Viele moderne Krebsmedikamente auf Antikörperbasis sollen aber nicht in erster Linie das Immunsystem auf den Tumor lenken: Sie werden gezielt entwickelt, um damit die Wirkung von Botenstoffen oder typische Stoffwechselwege in Tumorzellen zu blockieren, die für das Krebswachstum wichtig sind. Man bezeichnet sie deshalb auch als zielgerichtete Medikamente.
Ausnahme sind zum Beispiel die sogenannten Checkpoint-Inhibitoren: Diese Antikörper sollen gezielt das Immunsystem anregen, mehr dazu im nächsten Abschnitt.
Impfung als Vorbeugung gegen Krebs?
Heute sind mehrere Viren bekannt, die Krebs fördern. Impfungen gegen eine Infektion mit solchen Viren können vor Krebs schützen - allerdings gilt das nur für Krebsarten, die durch Viren gefördert werden, mehr dazu in einem eigenen Abschnitt.
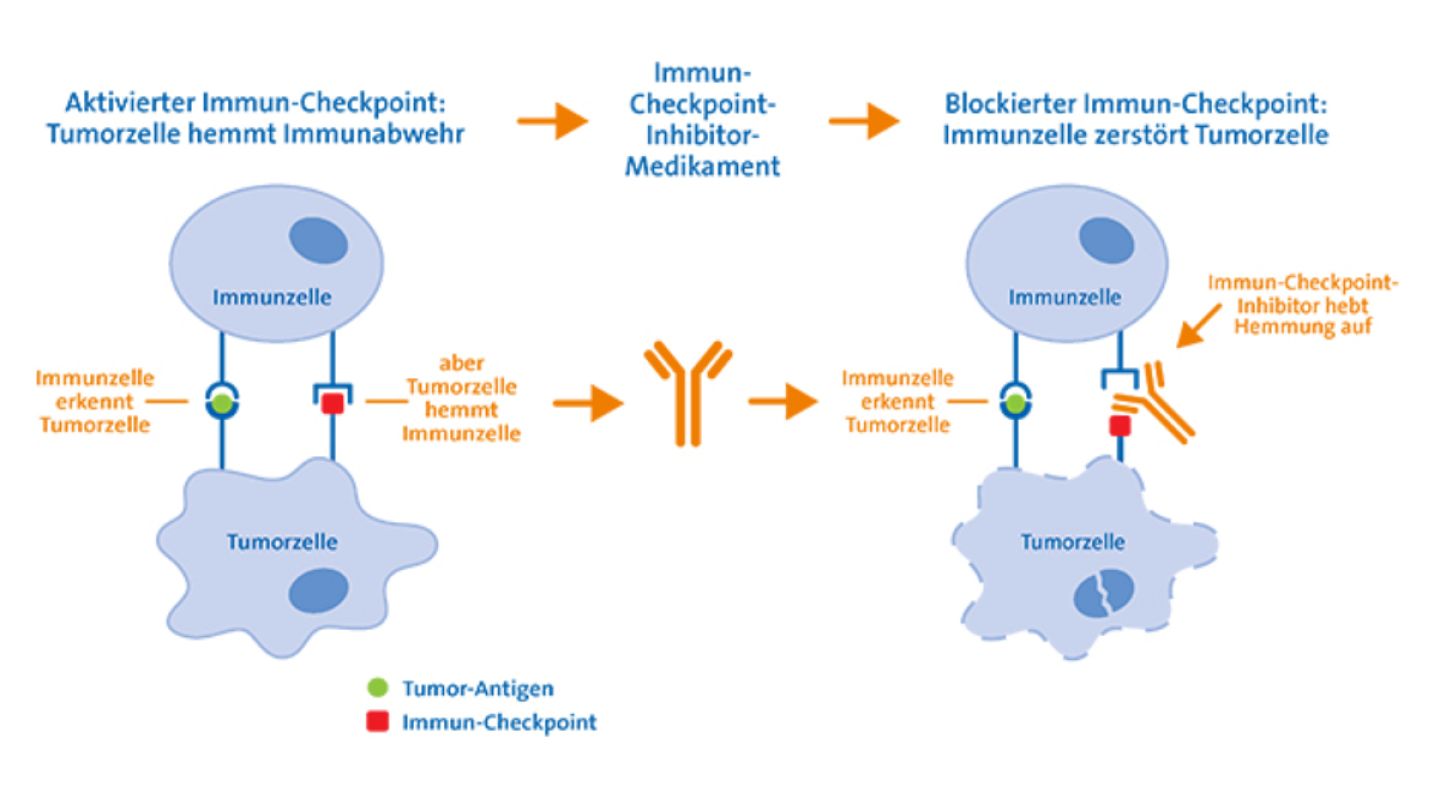
Immun-Checkpoint-Inhibitoren: Die Bremsen des Immunsystems lösen
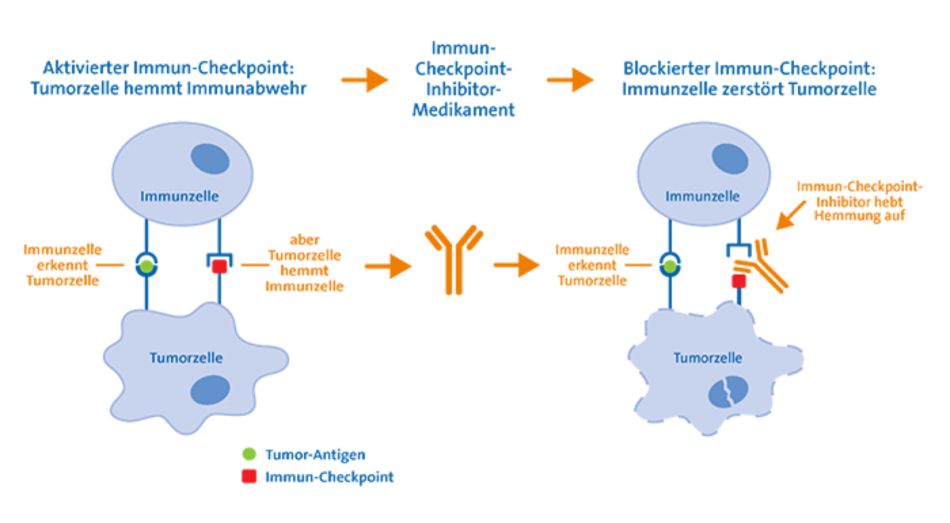
In den letzten Jahren wurden Antikörper entwickelt, die sich gezielt gegen eine Art "Bremsen" im Immunsystem richten: Diese Kontrollpunkte oder englisch "Checkpoints" verhindern normalerweise eine überschießende Reaktion des Immunsystems gegen eigene, gesunde Zellen, sogenannte Autoimmunreaktionen.
Manche Tumoren aktivieren gezielt solche "Immun-Checkpoints". Immunzellen, die den Tumor eigentlich erkennen und bekämpfen könnten, werden dadurch stark geschwächt. Sogenannte Immun-Checkpoint-Inhibitoren oder Checkpoint-Hemmer wirken dem entgegen: Sie verhindern die Unterdrückung der Immunantwort und bewirken so, dass das Immunsystem den Tumor verstärkt angreift.
Stellenwert: Inzwischen sind mehrere solcher Medikamente zur Krebstherapie zugelassen. Ein Beispiel ist der Antikörper Ipilimumab, der zur Behandlung von Patienten mit fortgeschrittenem schwarzem Hautkrebs eingesetzt wird. Weitere Krebsarten, für die es bereits zugelassene Checkpoint-Inhibitoren gibt, sind unter anderem Lungenkrebs, Blasenkrebs, Nierenzellkrebs, Darmkrebs, Magenkrebs, Speiseröhrenkrebs und das Hodgkin-Lymphom. Weitere Krebsarten folgen voraussichtlich in Kürze.
- Immun-Checkpoint-Hemmer sind bisher überwiegend zur Behandlung von Betroffenen mit fortgeschrittener Erkrankung zugelassen.
- Sie wirken nur bei einem Teil der Patienten - zeigt sich allerdings eine Wirkung, dann kann diese lange anhalten.
Weitere Checkpoint-Hemmer und ihre Wirkung bei anderen Krebsarten werden noch in klinischen Studien untersucht.
Wie wird die Behandlung mit Immun-Checkpoint-Hemmern durchgeführt?
Die Antikörper erhält man als Patient über eine Vene als Infusion. Die Abstände der Infusionen und die Behandlungsdauer unterscheiden sich je nach Medikament und Krebsart. Unter Umständen bekommt man auch eine Kombination von mehreren Checkpoint-Hemmern. Betroffene sollten mit ihren Ärzten besprechen, wie ihre Behandlung konkret geplant ist.
Welche Nebenwirkungen sind möglich?
Beschwerden beruhen vor allem auf überschießenden Immunreaktionen: Dazu gehören Fieber, Ausschläge und Juckreiz an der Haut, aber auch Entzündungen des Darms, der Leber, der Nieren oder der Lunge.Was lässt sich dagegen tun? Ärzte können bei Bedarf Medikamente gegen die Nebenwirkungen verschreiben. Sind die Nebenwirkungen nicht in den Griff zu bekommen, muss man allerdings als Betroffener auch mit einer Unterbrechung oder dem Abbruch der Krebstherapie rechnen.
Impfen gegen Krebs: Immunzellen gezielt gegen Tumoren richten
Tumorantigen: Krebstypisches Merkmal, das auf gesunden Zellen nicht oder nur in anderer Form oder Häufigkeit vorkommt. Das Immunsystem kann Tumorantigene erkennen und die Krebszellen daraufhin vernichten.
Mit verschiedenen Strategien versucht man, dem Immunsystem beizubringen, den Tumor selbst zu erkennen und zu bekämpfen. Solche Verfahren werden gegen Krebs nicht vorbeugend angewendet, wie etwa eine Schutzimpfung gegen Viren, sondern erst, wenn Krebs schon ausgebrochen ist. Daher bezeichnet man sie als therapeutische Impfungen.
Wichtig sind dabei sogenannte Tumorantigene: Merkmale, die typisch für Krebszellen sind und auf gesunden Körperzellen gar nicht oder nur in anderer Form oder Häufigkeit vorkommen. Auf solche Antigene soll das Immunsystem "angesetzt" werden und Zellen vernichten, die diese Merkmale tragen. Geimpft wird dabei entweder mit Teilen von Krebszellen. Oder man verändert Immunzellen außerhalb des Körpers und trainiert sie sozusagen im Reagenzglas. Diese Zellen sollen dann - zurück im Patienten - den Tumor bekämpfen und/oder weitere Immunzellen aktivieren.
- Die meisten dieser Ansätze sind bisher experimentell und kein Standard in der Krebstherapie.
Tumorvakzinen: Das Immunsystem auf Tumorantigene aufmerksam machen
Als Vakzin bezeichnet man einen Impfstoff, der im Körper eine Immunreaktion auslöst. Krebsvakzinen sollen eine Reaktion gegen Tumorantigene hervorrufen. Dafür impft man diese Eiweiße oder Abschnitte davon zusammen mit Substanzen, die die Immunantwort verstärken. Eine andere Möglichkeit: Statt des fertigen Eiweißes lässt sich auch sein genetischer Bauplan, also ein Stück Erbmaterial als Impfstoff verwenden. Oder man benutzt ganze Tumorzellen, die nicht mehr wachstumsfähig sind und "zeigt" dem Immunsystem damit gleich mehrere mögliche Tumorantigene.
Stellenwert: Solche Tumorimpfungen sind bisher nicht zur Krebstherapie zugelassen. Sie werden entweder noch in der Grundlagenforschung untersucht oder in klinischen Studien geprüft. Teilweise sind erste Ergebnisse vielversprechend. Andere Ansätze haben sich jedoch als nicht wirksam herausgestellt. Insgesamt fehlen noch Daten, um beurteilen zu können, ob solche Impfungen Betroffenen helfen können.
Dendritische Zellen: Helfer bei der Aktivierung von Immunzellen
Statt Tumorantigene direkt als Vakzinen zu benutzen, kann man auch bestimmte Immunzellen außerhalb des Körpers mit ihnen beladen: Diese sogenannten dendritischen Zellen sind darauf spezialisiert, Fremdstoffe aufzunehmen und sie weiteren Immunzellen zur Erkennung zu präsentieren. Die Hoffnung: Das Immunsystem erkennt Tumorantigene besser, die es von dendritischen Zellen gezeigt bekommt.
Die Immunzellen werden dem Patienten oder der Patientin entnommen, mit Antigenen beladen und aktiviert. Zurück im Körper sollen sie weitere Immunzellen aktivieren und damit eine spezifische Immunantwort gegen die Tumorantigene hervorrufen. Das Verfahren, das auch als Dendritische Zelltherapie bezeichnet wird, ist sehr aufwändig, da die Impfung für jeden Patienten individuell hergestellt werden muss.
Stellenwert: Die Impfung mit dendritischen Zellen ist kein Standard in der Krebsbehandlung: Die meisten dieser Ansätze müssen noch weiter geprüft werden. Ob sie gegen Krebs wirksam sind, steht noch nicht fest. Genehmigt ist in Deutschland bisher nur der therapeutische Impfstoff DCVax®-L, zur Behandlung von Patienten mit Gliomen. Zwischen Herbst 2013 und Mai 2015 war in der Europäischen Union außerdem Sipuleucel-T (Provenge®) zur Behandlung von Patienten mit fortgeschrittenem Prostatakrebs zugelassen. Inzwischen hat der Hersteller allerdings die Zulassung in Europa zurückgezogen.
Adoptiver T-Zell-Transfer: Immunzellen im Labor aktivieren
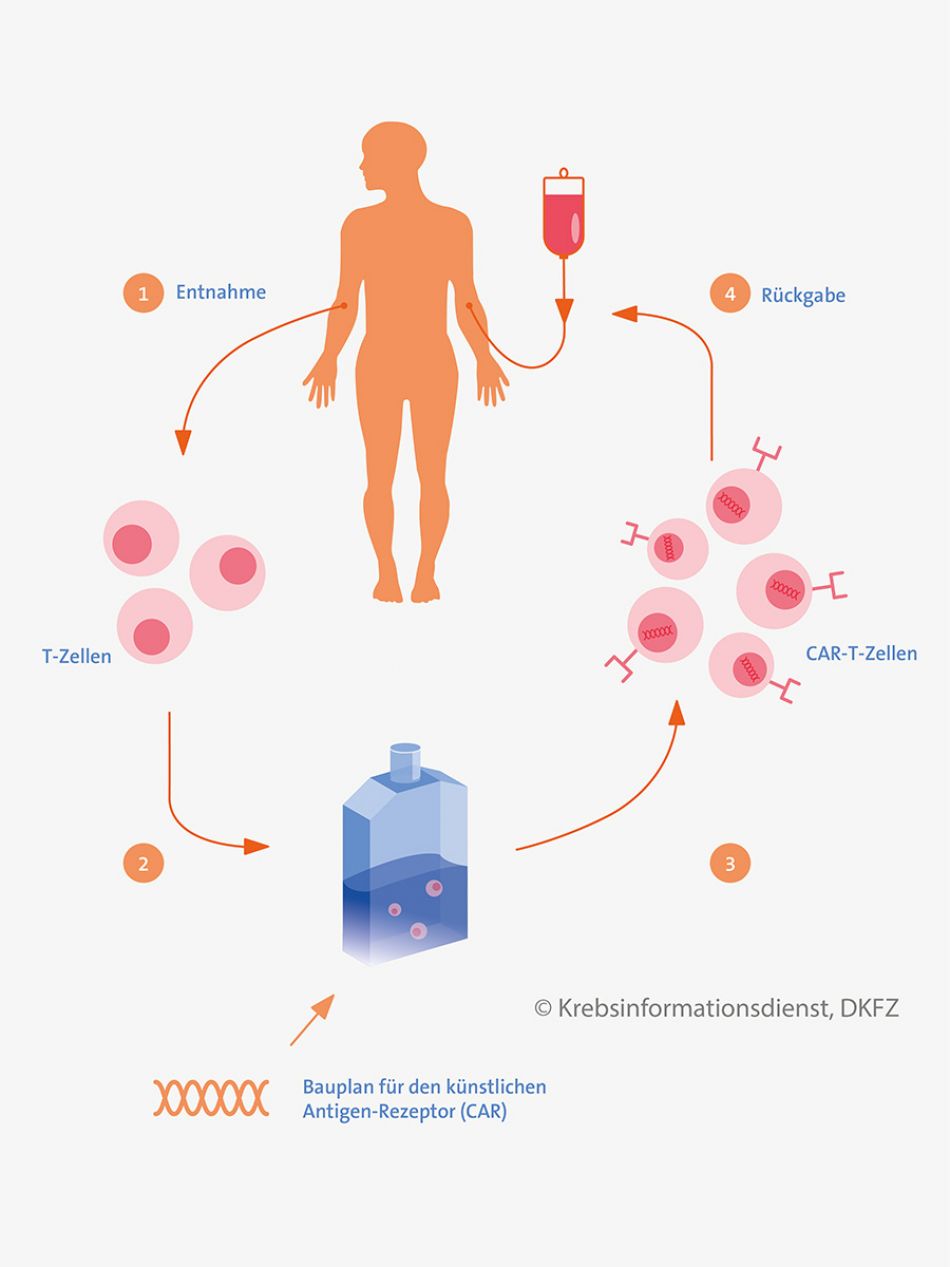
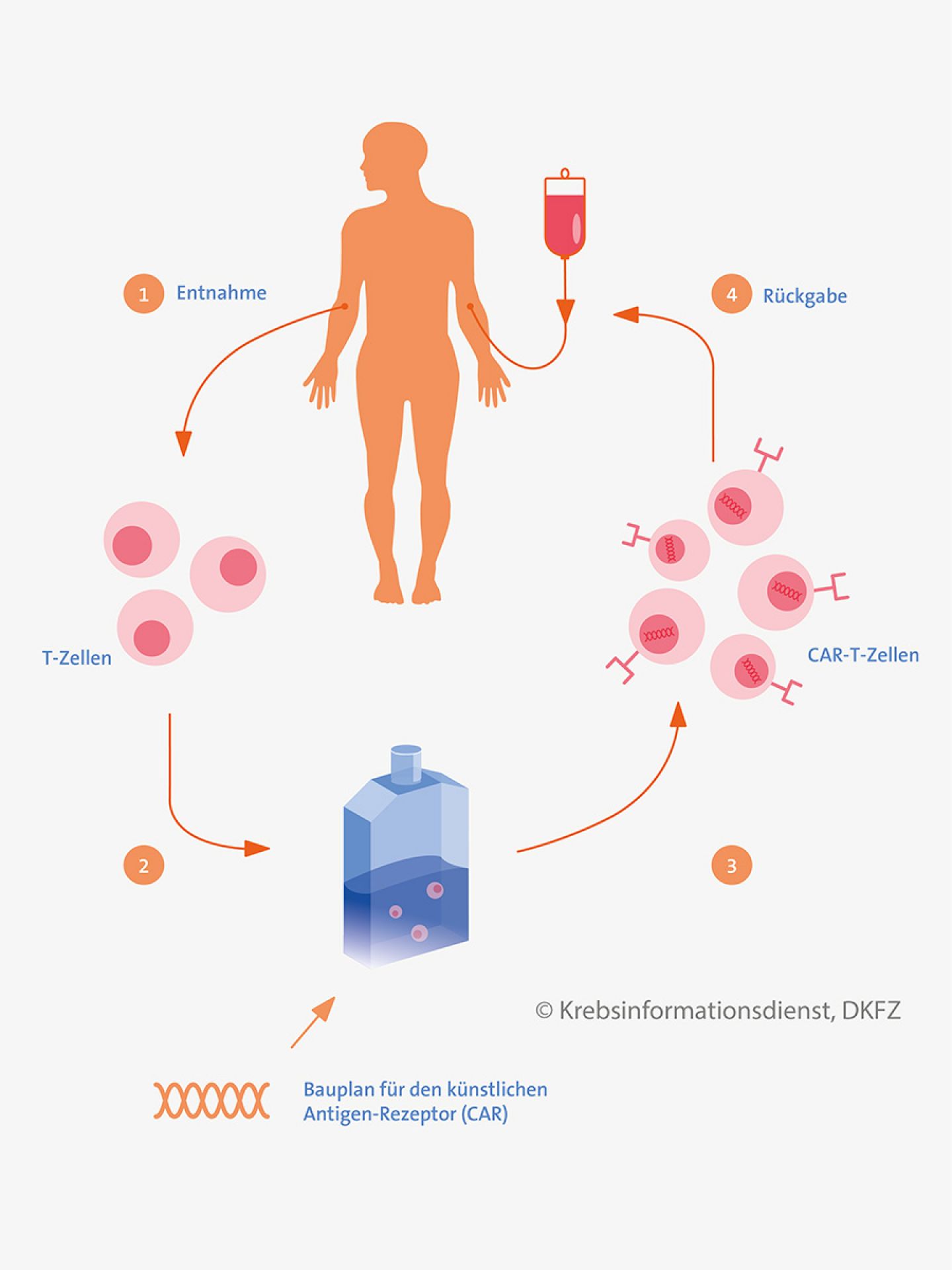
Beim sogenannten adoptiven Transfer von T-Lymphozyten verwendet man T-Zellen, die Krebszellen zerstören können. Dies ist also zunächst keine aktive Immunisierung, sondern ein passives Verfahren: Betroffene erhalten außerhalb des Körpers aktivierte Immunzellen. Neue Untersuchungen deuten allerdings darauf hin, dass durch die Behandlung auch eine dauerhafte Immunantwort hervorgerufen werden kann.
Bei dem Verfahren entnimmt man zunächst T-Zellen aus dem Blut, dem Knochenmark oder aus Tumorgewebe des Patienten oder der Patientin. Bei manchen Ansätzen verwenden Forscher auch Zellen eines gesunden Spenders. Die Immunzellen werden im Labor vermehrt und dabei tumorspezifische T-Zellen angereichert. Oder die T-Zellen werden gentechnisch so verändert, dass sie bestimmte Tumorantigene erkennen können. Dann bezeichnet man sie als CAR-T-Zellen (T-Zellen mit chimärem Antigenrezeptor). Die so veränderten Immunzellen erhält der Betroffene zurück.
Stellenwert CAR-T-Zellen: 2018 wurden die ersten Verfahren mit T-Zellen zugelassen: Es handelt sich um CAR-T-Zellen, die zur Behandlung von Patientinnen und Patienten mit bestimmten Leukämien und Lymphomen eingesetzt werden, bei denen andere Therapien nicht ausreichend gewirkt haben.
Das Verfahren ist sehr aufwändig. Hinzu kommt: Einige Betroffene entwickeln starke Nebenwirkungen und müssen sorgfältig überwacht werden. Die Behandlung wird daher nur an spezialisierten Zentren in Deutschland durchgeführt.
Ob CAR-T-Zellen auch bei anderen Tumorarten wirken, wird derzeit zunächst in frühen klinischen Studien geprüft. Auch weitere Verfahren mit T-Zellen werden in der Grundlagenforschung und in frühen klinischen Studien erforscht und stehen noch nicht regulär zur Krebstherapie zur Verfügung.
Zytokin-induzierte Killerzellen (CIK)
Inzwischen erforschen Wissenschaftler auch Ansätze, die eine Mischung aus verschiedenen Immunzellen nutzen. Diese werden im Labor mit sogenannten Zytokinen vermehrt, deshalb heißen sie auch Zytokin-induzierte Killerzellen. Darunter befinden sich auch Unterarten von T-Zellen, aber auch weitere Immunzellen, die in der Lage sind, Krebszellen zu zerstören.
Blutstammzelltransplantation bei Leukämien und Lymphomen: Spenderzellen zerstören auch Tumorzellen
Eine Blutstammzelltransplantation kommt für manche Patienten mit sonst nur schlecht unter Kontrolle zu bringenden Leukämien oder Lymphomen infrage. Um das erkrankte Knochenmark der Betroffenen zu zerstören, erhalten sie eine hoch dosierte Chemo- oder Strahlentherapie. Danach muss das Knochenmark allerdings ersetzt werden, sonst kommen die Blutbildung und damit der Sauerstofftransport, die Blutgerinnung und auch das Immunsystem zum Erliegen. Bei einer autologen Stammzelltransplantation erhalten Patienten eigene, gereinigte Stammzellen zurück.
Bei einer sogenannten allogenen Transplantation erhalten Betroffene dagegen Stammzellen eines Spenders. Heute weiß man: Diese ersetzen nicht nur die vernichteten Blutstammzellen. Die daraus entstehenden neuen Immunzellen können außerdem eventuell noch vorhandene Tumorzellen des Empfängers zerstören. Dabei nutzt man aus, dass die Gewebemerkmale des Spenders praktisch nie hundertprozentig mit denen des Empfängers übereinstimmen: Noch verbliebene Leukämie- oder Lymphomzellen werden vom neuen Immunsystem als "fremd" erkannt. Im weiteren Sinn kann man die Blutstammzelltransplantation daher auch als Immuntherapie bezeichnen - auch wenn nicht körpereigene, sondern Immunzellen des Spenders die Tumorzellen zerstören.
Schutzimpfung gegen Krebsviren: Kann man damit Tumorerkrankungen vorbeugen?
Manche Viren können Krebs auslösen: Sie spielen eine wichtige Rolle bei der Entstehung bestimmter Tumorarten. Dazu gehören zum Beispiel Papillomviren, die mit Krebs am Gebärmutterhals, im Genitalbereich und in Mund und Rachen in Verbindung gebracht werden, oder Viren aus der Hepatitis-Gruppe, die Leberkrebs verursachen könnten. In Industrieländern werden nach Schätzungen von Experten etwa neun Prozent aller Krebserkrankungen durch Viren oder Bakterien verursacht, in Entwicklungsländern ist der Anteil höher.
Wie gefährlich sind solche Krebsviren? Bei weitem nicht jede Infektion löst Krebs aus: Nur ein Bruchteil der infizierten Menschen entwickelt langfristig einen Tumor. Dabei spielen auch weitere Risikofaktoren eine Rolle.
Vorbeugende Krebs-Impfung: Vor was schützt sie?

Dennoch könnten Schutzimpfungen gegen solche Erreger indirekt Krebs verhindern und so die Zahl der durch Infektionen ausgelösten Krebsarten zukünftig senken. Eine Impfung gegen krebsauslösende Viren kann man daher auch als vorbeugende "Krebs-Impfung" bezeichnen. Bislang stehen allerdings nur gegen wenige Krebsviren geeignete Impfstoffe zur Verfügung. Die Wichtigsten schützen vor Papillomviren und Hepatitis. Gedacht sind sie nur für Gesunde. Sie helfen nicht, wenn Krebs schon ausgebrochen ist.
Derzeit wird allerdings auch erforscht, ob sich Viruseiweiße auch als Angriffsziele für eine therapeutische Impfung eignen. Denn solche Eiweiße finden sich auch in Tumorzellen, wenn die Krebserkrankung durch ein Virus ausgelöst wurde. Sie könnten deshalb auch als Tumorantigen dienen. Bisher gibt es allerdings nur frühe klinische Studien zu diesem Ansatz.
Über Viren als Krebsauslöser und die heute zur Verfügung stehenden Impfstoffe zur Vorbeugung gegen eine Infektion informiert der Krebsinformationsdienst in einem eigenen Text: Viren und Krebs: Können Impfungen schützen?.
Virotherapie: Viren gegen Krebs
Onkolytische Viren: Als onkolytisch werden Viren bezeichnet, die gezielt Krebszellen befallen und zerstören können. Manche Viren tun das natürlicherweise. Andere kann man künstlich tumorspezifisch machen.
Als onkotrope Viren bezeichnet man Erreger, die gezielt Tumorzellen infizieren können. Es gibt Viren, die natürlicherweise bevorzugt menschliche Krebszellen befallen. Andere kann man künstlich tumorspezifisch machen. Können die Viren die Tumorzellen nach der Infektion auch zerstören, nennt man sie onkolytische Viren.
Die Viren sollen Krebszellen direkt abtöten - allerdings ohne ansonsten eine schwere Erkrankung beim Betroffenen auszulösen. Ein weiterer erhoffter Effekt des Virusbefalls ist die Aktivierung des Immunsystems: Immunzellen erkennen die infizierten Tumorzellen und zerstören sie. Einmal aktiviert, erkennen sie aber auch noch nicht virusbefallene Krebszellen und vernichten auch diese.
Welche Viren werden erforscht?
Als Kandidaten gelten beispielsweise bestimmte Parvoviren, die beim Menschen keine bekannten Erkrankungen hervorrufen. Adenoviren, zu denen auch Schnupfenviren gehören, werden geprüft, weil sie vergleichsweise wenige Erkrankungen oder nur eher harmlose Folgen hervorrufen. Weitere Beispiele sind gentechnisch veränderte und harmlos gemachte Masern- und Herpesviren.
Welchen Stellenwert hat die Virotherapie?
Die onkolytische Virotherapie ist bisher ein weitgehend experimenteller Ansatz: Es liegen vor allem Daten aus vorklinischer Forschung vor, also aus Tests an Zellen, Geweben und aus Tierversuchen. Erste Studien an Patienten wurden zwar in mehreren Ländern durchgeführt. Diese frühen Studien dienten jedoch überwiegend dazu, die Sicherheit der Behandlungsmethode zu bestimmen.
Europaweit ist bisher nur ein Produkt zugelassen: eine Virotherapie mit dem Arzneimittel Imlygic®, das ein gentechnisch verändertes Herpesvirus beinhaltet. Erhalten können es Patienten mit fortgeschrittenem, anders nicht behandelbarem Hautkrebs. Als Gentherapie unterliegt der Einsatz dieses Medikaments einer besonderen Überwachung.
Weitere Ansätze werden in klinischen Studien getestet.
- Zu den Risiken einer Virotherapie sind jedoch noch viele Fragen unbeantwortet. Dies macht große Vorsicht bei der Planung und Durchführung der Studien notwendig.
Teilweise gab es erste ermutigende Ergebnisse. Viele Ansätze sind jedoch nicht so wirksam, dass sie als alleinige Therapie infrage kommen. Deshalb versucht man zum Beispiel, sie mit etablierten Therapien wie Chemo- oder Strahlentherapie zu kombinieren. Außerdem erproben Forscher, wie man die Wirksamkeit der Virotherapie an sich verbessern kann: Zu Beispiel, indem sie onkotrope Viren als Träger für weitere Substanzen nutzen. Oder sie verändern die Viren gentechnisch so, dass diese die Tumorzellen leichter befallen können oder die Immunantwort gegen die Krebszellen verstärken.
- Noch ist es zu früh, um den Nutzen und die Risiken der meisten Behandlungsansätze mit onkolytischen Viren abschließend beurteilen zu können.
Antikörper: Wichtige Helfer in der Krebstherapie
Antikörper sind Eiweißmoleküle, die körperfremde und gegebenenfalls auch körpereigene, aber veränderte Strukturen als Antigen erkennen. Sie werden normalerweise von Immunzellen produziert, lassen sich aber auch außerhalb des Körpers herstellen. Antikörper haben einen wichtigen Stellenwert in der Krebstherapie, aber auch in der Diagnostik.
Die meisten heute zur Krebstherapie zugelassenen Antikörper wirken allerdings nicht als Immuntherapie im klassischen Sinn: Sie regen das körpereigene Immunsystem nur in geringem Maße an, den Tumor selbst zu bekämpfen. Sie wurden entwickelt, um spezifisch überlebenswichtige Stoffwechselwege in den Tumorzellen zu blockieren. Man bezeichnet sie daher auch als zielgerichtete Therapien, mehr dazu im Text Zielgerichtete Krebstherapien: Targeted Therapies.
Ein Sonderfall sind die oben beschriebenen Immun-Checkpoint-Inhibitoren: Sie lösen gezielt Bremsmechanismen des Immunsystems und regen es dadurch an, den Tumor zu bekämpfen.
Außerdem gibt es sogenannte bispezifische Antikörper: Sie haben auf ihren beiden Armen verschiedene Bindungsstellen, eine für ein Tumorantigen und eine für Immunzellen. Damit sollen sie Immunzellen zu den Tumorzellen locken, die diese dann zerstören. Bereits als Medikament zugelassen ist beispielsweise Blinatumomab, zur Behandlung von Patienten mit einer Form der akuten Leukämie. Das enthaltene Molekül ist allerdings kein echter Antikörper, sondern ein kleineres Antikörper-ähnliches Eiweiß: Es koppelt die entarteten Immunzellen mit T-Zellen, die diese zerstören sollen.
- Einen Überblick über die verschiedenen Einsatzgebiete von Antikörpern in der Krebsmedizin gibt der Text Antikörper in der Krebsmedizin: Wichtige Helfer bei der Diagnose und Therapie von Krebserkrankungen.
Zytokine: Botenstoffe des Immunsystems
Zytokine sind Eiweißverbindungen, die als Botenstoffe des Körpers dienen: Sie steuern zum Beispiel Wachstum und Vermehrung von Zellen oder locken Zellen in Gewebe, in denen sie gebraucht werden. Unter anderem haben sie eine wichtige Funktion bei der Steuerung der Immunreaktion. In der Krebstherapie spielen vor allem die sogenannten Interferone und Interleukine eine Rolle:
Interferone werden im Körper zum Beispiel als Reaktion auf eine Virusinfektion gebildet. Man kann sie aber auch künstlich herstellen und als Medikament einsetzen. Sie aktivieren verschiedene Abwehrzellen des Immunsystems.
Sie haben aber auch einen direkten Effekt auf Tumorzellen: Zum Beispiel hemmen sie deren Wachstum und können den programmierten Zelltod auslösen, die sogenannte Apoptose. Sie bewirken aber auch, dass die Krebszellen vom Immunsystem besser erkannt werden.
Interleukine werden natürlicherweise von Immunzellen gebildet. Sie sind für die Kommunikation der Immunzellen untereinander wichtig. In der Krebsbehandlung spielt vor allem Interleukin-2 eine Rolle, das hauptsächlich die Vermehrung von T-Zellen anregt - auch solchen, die den Tumor bekämpfen können.
Wie ist der Stellenwert der Zytokine?
Verschiedene Interferone und Interleukine werden in der Krebstherapie eingesetzt oder in Studien getestet. Sie haben allerdings die anfangs in sie gesetzten großen Hoffnungen überwiegend nicht erfüllt: Zytokine wirken nur bei wenigen Tumorarten und auch da nicht bei allen Patienten.
Zugelassen ist zum Beispiel Interferon alpha zur Behandlung von Patienten mit Melanom, mit Formen von Leukämien oder Lymphomen und für Betroffene mit fortgeschrittenem Nierenzellkarzinom.
Interleukin-2 können Betroffene mit fortgeschrittenem Hautkrebs oder Nierenzellkrebs erhalten.
Viele Patienten haben während einer Therapie mit Zytokinen belastende, etwa grippeähnliche Symptome, Durchfall oder Veränderungen der Haut oder des Blutbildes und mehr. Zytokine werden daher zunehmend von neueren, besser wirksamen und nebenwirkungsärmeren Medikamenten abgelöst, oder die Zytokine werden mit diesen kombiniert.
Weitere Immunmodulatoren: Lange bekannte Wirkstoffe als neue Krebsmedikamente
Der Wirkstoff Thalidomid ist schon seit mehreren Jahrzehnten bekannt. Traurige Berühmtheit erlangte er Anfang der 1960er Jahre unter dem Markennamen Contergan. Das damals als Schlaf- und Beruhigungsmittel eingesetzte Medikament rief schwere Missbildungen bei Kindern hervor, deren Mütter es in der Schwangerschaft genommen hatten. Seit einigen Jahren wird Thalidomid in der Krebstherapie eingesetzt. Inzwischen gibt es auch verwandte Wirkstoffe wie Lenalidomid und Pomalidomid.
Diese Stoffe haben eine sogenannte immunmodulatorische Wirkung: Sie fördern zum Beispiel Vermehrung und Aktivierung verschiedener Immunzellen und die Ausschüttung von Botenstoffen des Immunsystems. Außerdem wirken sie entzündungshemmend. Sie hemmen aber auch die Ausbildung von Blutgefäßen im Tumor sowie das Wachstum von Krebszellen und können diese direkt zum Absterben bringen. Daher kann man sie nicht nur zur Immuntherapie, sondern auch zur Gruppe der zielgerichteten Therapien zählen.
Stellenwert: Die Wirkstoffe sind zur Behandlung von Patienten mit verschiedenen Tumorarten des blutbildenden und lymphatischen Systems zugelassen, zum Beispiel dem Multiplen Myelom. Sie werden als Kapseln geschluckt. Nebenwirkungen sind beispielsweise Veränderungen des Blutbildes, Verstopfung, Durchfall oder Wasseransammlungen im Gewebe. Außerdem wirken die Medikamente stark fruchtschädigend, daher müssen Frauen im gebärfähigen Alter auf jeden Fall eine Schwangerschaft vermeiden und die Abgabe der Medikamente ist an strenge Auflagen gebunden.
Bacillus Calmette Guerin: Tuberkulose-Bakterien gegen Krebs
Untersuchungen haben gezeigt, dass abgeschwächte Tuberkulose-Bakterien in Krebszellen aufgenommen werden und dann eine Immunreaktion gegen den Tumor auslösen können. Daher setzt man bereits seit einigen Jahrzehnten Tuberkulose-Lebendimpfstoffe zur Krebsbehandlung ein. Mit dem Impfstoff werden Patienten mit Harnblasenkrebs behandelt, bei denen nach einer Operation ein höheres Rückfallrisiko besteht. Betroffenen wird mit dem Medikament wiederholt die Harnblase gespült, um eine örtliche Immunreaktion hervorzurufen.
Erfolgsaussichten: Gibt es Tumoren, die besonders gut auf Immuntherapien ansprechen?
Es gibt Tumorarten, die auf eine Immuntherapie kaum ansprechen. Und es gibt Krebsformen, bei denen das Immunsystem anscheinend eine wichtigere Rolle spielt. Sie bilden vermutlich häufiger als andere Tumorantigene aus, die das Immunsystem erkennen kann. Solche "immunogenen" Krebsarten sind einer Immuntherapie am ehesten zugänglich.
Zu dieser Gruppe gehören zum Beispiel das Melanom, das Nierenzellkarzinom und der nicht-kleinzellige Lungenkrebs. Allerdings sprechen nicht alle Patienten mit Hautkrebs, Nierenzellkrebs oder Lungenkrebs gleich gut auf eine Immuntherapie an. Warum das so ist, und ob man zuverlässig vorhersagen kann, wem eine Immuntherapie nützt und wem nicht, ist bisher noch nicht vollständig klar und muss weiter untersucht werden.
Auch die Frage, ob und wie man wenig oder gar nicht immunogene Tumoren einer Bekämpfung durch das Immunsystem zugänglich machen kann, ist noch nicht abschließend beantwortet.
Klinische Studien: Forschung an neuen Methoden der Immuntherapie
Viele Verfahren aus dem Bereich der Immuntherapie befinden sich noch in der vorklinischen Entwicklung oder müssen in klinischen Studien getestet werden. Nutzen und Risiken dieser Ansätze lassen sich daher noch nicht ausreichend beurteilen. Außerdem wird im Moment in Studien geprüft, ob man Immuntherapien mit anderen Krebsbehandlungen wie Chemo- oder Strahlentherapie oder verschiedene Immuntherapie-Methoden miteinander kombinieren kann, um die Wirksamkeit zu erhöhen.
- Wer sich darüber informieren möchte, wie klinische Studien ablaufen, oder über die Teilnahme an einer solchen Studie nachdenkt, findet Informationen dazu in den Texten Krebsforschung: Neue Verfahren, neue Medikamente, klinische Studien.
Kommerzielle Angebote: Nutzen und Risiken sind unbekannt
Medienberichte über Immunforschung und erste Erfolge mit Immuntherapien haben zu großen Erwartungen in diese Form der Krebstherapie geführt. Solche Hoffnungen bergen jedoch auch das Risiko für ein Geschäft mit der Angst Betroffener: Es gibt Anbieter, die Krebspatienten gegen Geld Mittel zur unspezifischen Immunstärkung und nicht zugelassene Immuntherapien außerhalb von klinischen Studien anbieten. Die Angebote reichen von pflanzlichen Mitteln und Vitaminen zur Immunstärkung bis hin zu Krebsimpfungen, dendritischen Zellen oder "aktiv-spezifischen Immuntherapien". Oft kosten diese Therapien sehr viel, obwohl wenig über sie bekannt ist. Die Kosten werden von den Krankenkassen häufig nicht übernommen.
Was ist von solchen Angeboten zu halten?
Schaut man genauer hin, können die meisten dieser eher kommerziell orientierten Anbieter keine wissenschaftlich nachvollziehbaren Daten zur Überprüfung ihrer Methoden vorlegen. Das bedeutet: Es ist weder nachgewiesen, dass die von ihnen angebotene Form der Immuntherapie wirksam ist, noch kann man Genaues über mögliche Risiken der Behandlung sagen. Eine starke Aktivierung des Immunsystems birgt beispielsweise die Gefahr, dass sich die Immunzellen auch gegen den eigenen Körper richten und schwere Autoimmunreaktionen auslösen.
- Experten empfehlen daher, nicht zugelassene Immuntherapeutika nur unter kontrollierten Bedingungen in klinischen Studien einzusetzen.
Woran erkennt man kommerzielle Angebote? Woran erkennt man, ob man in einer kontrollierten Studie behandelt werden soll? Der wichtigste Unterschied: In klinischen Studien zahlt man in der Regel nichts für die Therapie, und man erhält eine sogenannte Probandenversicherung, um zumindest finanziell gegen Risiken abgesichert zu sein. Echte klinische Studien müssen außerdem durch die regional zuständige Ethikkommission genehmigt worden sein.
Für Schwerkranke kann eine bislang nicht zugelassene Immuntherapie trotzdem attraktiv sein. Dann sollte man sich aber zumindest so umfassend wie möglich über die angebotene Methode informieren: über bekannte Erfolge, aber auch über Misserfolge sowie Risiken und Nebenwirkungen, die mit der Therapie verbunden sein können. Auch die Qualifikation des Anbieters und seine Zusammenarbeit mit weiteren Einrichtungen können Hinweise geben. Schließlich sollten die entstehenden Kosten und ihre Übernahme durch die Krankenkasse geklärt werden.
- Helfen kann dabei ein klärendes Gespräch mit dem Anbieter, in das die bisher behandelnden Ärzte und die Krankenkasse mit einbezogen werden sollten.
Quellen und Links für Interessierte und Fachkreise
Sie haben Fragen zur Immuntherapie? Wir sind für Sie da.
So erreichen Sie uns:
- am Telefon unter 0800 – 420 30 40, täglich von 8:00 bis 20:00 Uhr, kostenlos, vertraulich
- per E-Mail an krebsinformationsdienst@dkfz.de (der Link öffnet ein gesichertes Kontaktformular
Eine Einführung in die aktuelle Forschung bietet unter anderem das Deutsche Krebsforschungszentrum auf seinen Internetseiten unter www.dkfz.de/de/forschung/schwerpunkte/fsp-d.php.
krebsinformationsdienst.med: Service für Fachkreise aktuell – evidenzbasiert – unabhängig
Sie betreuen beruflich Menschen mit Krebs und haben Fragen? Mit dem Angebot krebsinformationsdienst.med unterstützt Sie der Krebsinformationsdienst bei Ihrer Arbeit, mit unabhängigen, aktuellen und qualitätsgesicherten Informationen. Der Service steht Ihnen von Montag bis Freitag zur Verfügung:
- telefonisch von 8:00 bis 20:00 Uhr unter 0800 – 430 40 50
- per E-Mail an kid.med@dkfz.de (der Link öffnet ein gesichertes Kontaktformular)
Quellen zum Weiterlesen (Auswahl)
Leitlinien
Leitlinien zur Tumortherapie deutscher Fachgesellschaften finden sich auf den Internetseiten der Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften e.V. (www.awmf.org/leitlinien.html). Den jeweils auf eine Tumorart bezogenen Leitlinien sind Informationen zum Stellenwert der jeweiligen immuntherapeutischen Verfahren zu entnehmen.
Rechtlicher Rahmen
In Deutschland unterliegen immuntherapeutische und gentherapeutische Ansätze der Aufsicht durch das Paul-Ehrlich-Institut (PEI), dem Bundesinstitut für Impfstoffe und biomedizinische Arzneimittel, www.pei.de. Insbesondere Virotherapien/Gentherapien dürfen nur unter besonderen Auflagen eingesetzt werden, auch nach der Zulassung, mehr unter www.pei.de/DE/arzneimittel/arzneimittel-node.html beim PEI.
Arzneimittel
Als Quelle für Aussagen zu Medikamenten hat der Krebsinformationsdienst aktuelle Fachinformationen der Hersteller herangezogen (über www.fachinfo.de für Fachkreise zugänglich), weiter Arzneimittelinformationen in deutschen Datenbanken (vor allem www.pharmnet.bund.de), aktuelle Hinweise des Bundesinstituts für Arzneimittel und Medizinprodukte unter www.bfarm.de sowie die Informationen der EU-Arzneimittelbehörde EMA unter www.ema.europa.eu/ema/.
Zu neueren Arzneimitteln können als Quelle auch Nutzenbewertungen gemäß § 35a des SGB V herangezogen werden. Die bisher vorliegenden Berichte sind abrufbar beim Institut für Qualität und Wirtschaftlichkeit in der Medizin unter www.iqwig.de, Stichwort „Projekte & Ergebnisse", dann „Publikationen".
Auch der Gemeinsame Bundessausschuss (G-BA) als Auftraggeber der Nutzenbewertung bietet Informationen zu aktuellen Änderungen. In der Regel handelt es sich dabei um Anpassungen der Arzneimittel-Richtlinie. Eine Übersicht bietet der G-BA unter www.g-ba.de/institution/themenschwerpunkte/arzneimittel/.
Weiterführende Informationen bieten die Deutsche Gesellschaft für Immunologie (www.dgfi.org/index.php) oder zum Beispiel die Internationale Union Immunologischer Gesellschaften (International Union of Immunological Societies IUIS, www.iuisonline.org).
Allgemeine Übersichtsartikel:
Fachveröffentlichungen sind über wissenschaftliche Bibliotheken oder kostenpflichtige Onlinedienste zugänglich, bei einigen sind auch Abstracts oder Volltexte frei verfügbar.
Aldrich JF, Lowe DB, Shearer MH, Winn RE, Jumper CA, Kennedy RC. Vaccines and immunotherapeutics for the treatment of malignant disease. Clin Dev Immunol. 2010: 697158. doi: 10.1155/2010/697158.
Baxi S, Yang A, Gennarelli RL, Khan N, Wang Z, Boyce L, Korenstein D.Immune-related adverse events for anti-PD-1 and anti-PD-L1 drugs: systematic review and meta-analysis. BMJ. 2018 Mar 14;360:k793. doi: 10.1136/bmj.k793.
Blankenstein T, Coulie PG, Gilboa E, Jaffee EM. The determinants of tumour immunogenicity. Nat Rev Cancer. 2012 Mar 1;12(4):307-13. doi: 10.1038/nrc3246.
van den Boorn JG, Hartmann G. Turning tumors into vaccines: co-opting the innate immune system. Immunity. 2013 Jul 25;39(1):27-37. doi: 10.1016/j.immuni.2013.07.011.
Ferraro B, Morrow MP, Hutnick NA, Shin TH, Lucke CE, Weiner DB. Clinical applications of DNA vaccines: current progress. Clin Infect Dis. 2011 Aug 1;53(3):296-302. doi: 10.1093/cid/cir334.
Floros T, Tarhini AA. Anticancer Cytokines: Biology and Clinical Effects of Interferon-α2, Interleukin (IL)-2, IL-15, IL-21, and IL-12. Semin Oncol. 2015 Aug;42(4):539-48. doi: 10.1053/j.seminoncol.2015.05.015.
Friedman CF, Proverbs-Singh TA, Postow MA. Treatment of the Immune-Related Adverse Effects of Immune Checkpoint Inhibitors: A Review. JAMA Oncol. 2016 Oct 1;2(10):1346-1353. doi: 10.1001/jamaoncol.2016.1051.
Fusi A, Festino L, Botti G, Masucci G, Melero I, Lorigan P, Ascierto PA. PD-L1 expression as a potential predictive biomarker. Lancet Oncol. 2015 Oct;16(13):1285-7. doi: 10.1016/S1470-2045(15)00307-1.
Harris SJ, Brown J, Lopez J, Yap TA. Immuno-oncology combinations: raising the tail of the survival curve. Cancer Biol Med. 2016 Jun;13(2):171-93. doi: 10.20892/j.issn.2095-3941.2016.0015.
Hartmann J, Schüßler-Lenz M, Bondanza A, Buchholz CJ. Clinical development of CAR T cells-challenges and opportunities in translating innovative treatment concepts. EMBO Mol Med. 2017 Aug 1. pii: e201607485. doi: 10.15252/emmm.201607485.
Hellmann MD, Friedman CF, Wolchok JD. Combinatorial Cancer Immunotherapies. Adv Immunol. 2016;130:251-77. doi: 10.1016/bs.ai.2015.12.005. Epub 2016 Jan 12.
Houot R, Schultz LM, Marabelle A, Kohrt H. T-cell-based Immunotherapy: Adoptive Cell Transfer and Checkpoint Inhibition. Cancer Immunol Res. 2015 Oct;3(10):1115-22. doi: 10.1158/2326-6066.CIR-15-0190.
June CH, O'Connor RS, Kawalekar OU, Ghassemi S, Milone MC. CAR T cell immunotherapy for human cancer. Science. 2018 Mar 23;359(6382):1361-1365. doi:10.1126/science.aar6711.
Koster BD, de Gruijl TD, van den Eertwegh AJ. Recent developments and future challenges in immune checkpoint inhibitory cancer treatment. Curr Opin Oncol. 2015 Nov;27(6):482-8. doi: 10.1097/CCO.0000000000000221.
Lawler SE, Speranza MC, Cho CF, Chiocca EA. Oncolytic Viruses in Cancer Treatment: A Review. JAMA Oncol. 2016 Jul 21. doi: 10.1001/jamaoncol.2016.2064.
Lindner S, Krönke J. The molecular mechanism of thalidomide analogs in hematologic malignancies. J Mol Med (Berl). 2016 Dec;94(12):1327-1334. Epub 2016 Aug 5.
Lohmueller J, Finn OJ. Current modalities in cancer immunotherapy: Immunomodulatory antibodies, CARs and vaccines. Pharmacol Ther. 2017 Mar 16. pii: S0163-7258(17)30088-8. doi: 10.1016/j.pharmthera.2017.03.008.
Madorsky Rowdo FP, Baron A, Urrutia M, Mordoh J (2015): Immunotherapy in Cancer: A Combat between Tumors and the Immune System - You Win some, You Lose Some. Front Immunol. 2015 Mar 26;6:127. doi: 10.3389/fimmu.2015.00127. eCollection 2015.
Palucka K, Banchereau J. Dendritic-cell-based therapeutic cancer vaccines. Immunity. 2013 Jul 25;39(1):38-48. doi: 10.1016/j.immuni.2013.07.004.
Parker BS, Rautela J, Hertzog PJ. Antitumour actions of interferons: implications for cancer therapy. Nat Rev Cancer. 2016 Mar;16(3):131-44. doi: 10.1038/nrc.2016.14.
Plummer M, de Martel C, Vignat J, Ferlay J, Bray F, Franceschi S. Global burden of cancers attributable to infections in 2012: a synthetic analysis. Lancet Glob Health. 2016 Sep;4(9):e609-16. doi: 10.1016/S2214-109X(16)30143-7.
Schadendorf D, Schuler M. Checkpointinhibitoren. Onkologe 2017. 23:619–625. doi 10.1007/s00761-017-0219-5
Shen X, Zhao B. Efficacy of PD-1 or PD-L1 inhibitors and PD-L1 expression status in cancer: meta-analysis. BMJ. 2018 Sep 10;362:k3529. doi: 10.1136/bmj.k3529.
Snook AE, Waldman SA. Advances in cancer immunotherapy. Discov Med. 2013 Feb;15(81):120-5.
Tao Z, Li S, Ichim TE, Yang J, Riordan N, Yenugonda V, Babic I, Kesari S. Cellular immunotherapy of cancer: an overview and future directions. Immunotherapy. 2017 Jun;9(7):589-606. doi: 10.2217/imt-2016-0086.
Wang Y, Zhou S, Yang F, Qi X, Wang X, Guan X, Shen C, Duma N, Vera Aguilera J, Chintakuntlawar A, Price KA, Molina JR, Pagliaro LC, Halfdanarson TR, Grothey A, Markovic SN, Nowakowski GS, Ansell SM, Wang ML. Treatment-Related Adverse Events of PD-1 and PD-L1 Inhibitors in Clinical Trials: A Systematic Review and Meta-analysis. JAMA Oncol. 2019 Apr 25. doi: 10.1001/jamaoncol.2019.0393. [Epub ahead of print]
Zou W, Wolchok JD, Chen L. PD-L1 (B7-H1) and PD-1 pathway blockade for cancer therapy: Mechanisms, response biomarkers, and combinations. Sci Transl Med. 2016 Mar 2;8(328):328rv4. doi: 10.1126/scitranslmed.aad7118.
Weitere Themen
Erstellt: 01.08.2017
Herausgeber: Deutsches Krebsforschungszentrum (DKFZ) │ Autoren/Autorinnen: Internet-Redaktion des Krebsinformationsdienstes. Lesen Sie mehr über die Verantwortlichkeiten in der Redaktion.
Aktualität: Wir prüfen alle Inhalte regelmäßig und passen sie an, wenn sich ein Aktualisierungsbedarf durch Veröffentlichung relevanter Quellen ergibt. Lesen Sie mehr über unsere Arbeitsweise.