Molekularbiologische Untersuchungen bei Krebs
So werden Biomarker gemessen
- Mit molekularbiologischen Methoden können Ärzte Eigenschaften von Tumorzellen untersuchen, sogenannte Biomarker.
- Es gibt unterschiedliche Verfahren. Welche Methode zum Einsatz kommt, hängt von der jeweiligen Fragestellung ab.
- Welche Untersuchungen es gibt und wie sie funktionieren, erläutern wir in diesem Text.
Biopsie: Gewinnung des Probenmaterials
Mit molekularbiologischen Methoden untersuchen Ärzte und Forscher Gewebe, Zellen oder Zellbestandteile auf bestimmte Eigenschaften. Das Material für eine solche Untersuchung gewinnen sie auf verschiedenen Wegen. Die zu untersuchenden Zellen oder Moleküle befinden sich zum Beispiel
- im Tumorgewebe,
- im Blut,
- im Urin,
- in der Hirnflüssigkeit (Liquor),
- in tumorbedingten Flüssigkeitsansammlungen, zum Beispiel im Brustraum (Pleuraerguss) oder im Bauchraum (Aszites).
Ärzte entnehmen eine Probe aus der zu untersuchenden Körperflüssigkeit oder dem Gewebe. Die Gewebeentnahme heißt Biopsie. Bei einer Probe aus einer Körperflüssigkeit spricht man auch von einer flüssigen Biopsie oder auf Englisch "liquid biopsy".
Meist muss diese Probe noch aufbereitet werden, bevor sie untersucht werden kann. Gewebeproben werden zum Beispiel eingefroren oder fixiert und in Paraffin eingebettet, Blutproben in verschiedene Bestandteile zerlegt. Häufig schicken Ärzte die Proben zur Untersuchung an ein spezialisiertes Labor. Bis Betroffene das Ergebnis bekommen, vergehen in der Regel mehrere Tage, manchmal auch Wochen.
Immunoassay: Biomarker-Nachweis mithilfe von Eiweißen
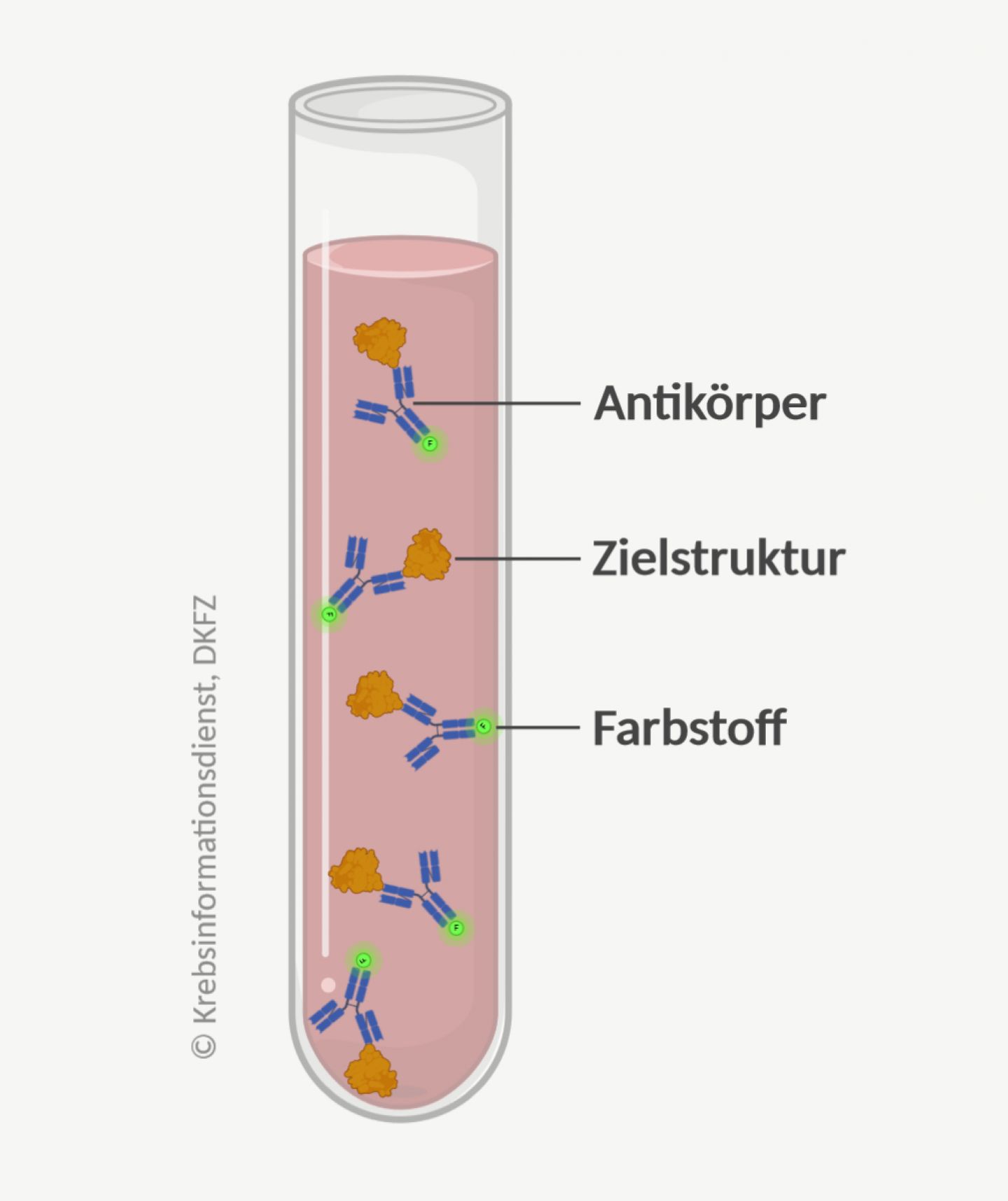
Um Biomarker in einer Probe nachzuweisen, setzen Ärzte und Forscher vor allem spezielle Antikörper ein, die für die Anwendung in der Diagnostik entwickelt und industriell produziert werden. Antikörper sind Eiweiße, die sehr spezifisch eine bestimmte Zielstruktur erkennen und binden. Weil sie Teil des Immunsystems sind, spricht man von einem Immunassay oder auch Immunoassay (assay engl. für Untersuchung).
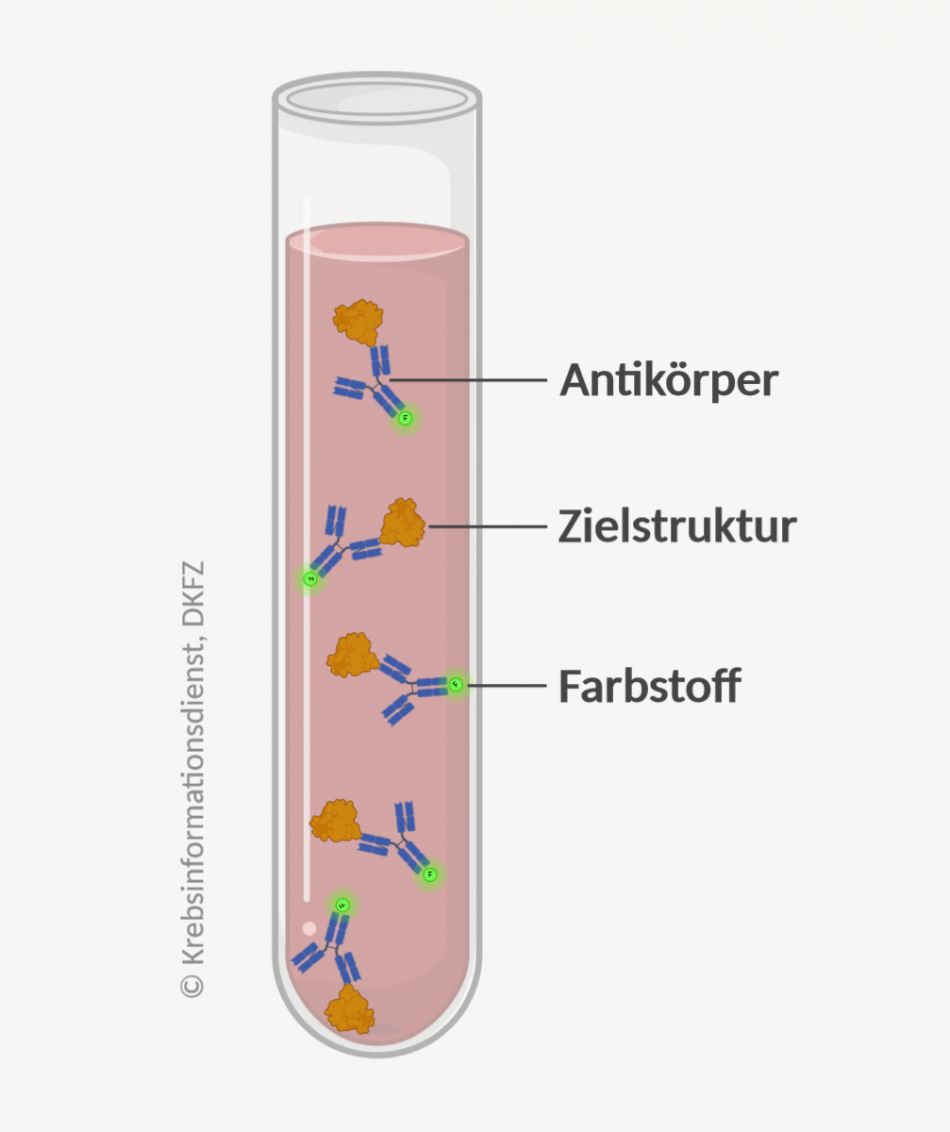
Die Menge der gebundenen Antikörper wird mithilfe von fluoreszierenden, radioaktiven Stoffen oder Farbstoffen sichtbar gemacht und gemessen.
Einsatzmöglichkeiten: Immunoassays nutzen Ärzte zum Beispiel zur Bestimmung von Tumormarkern in Körperflüssigkeiten. Auch Gewebeschnitte können mithilfe von Antikörpern gezielt angefärbt werden. Sie werden dann unter dem Mikroskop begutachtet. Die Untersuchung nennt sich Immunhistochemie, wenn ein fluoreszierender Farbstoff verwendet wird, auch Immunfluoreszenz.
PCR – Polymerasekettenreaktion: Erbgut vervielfältigen
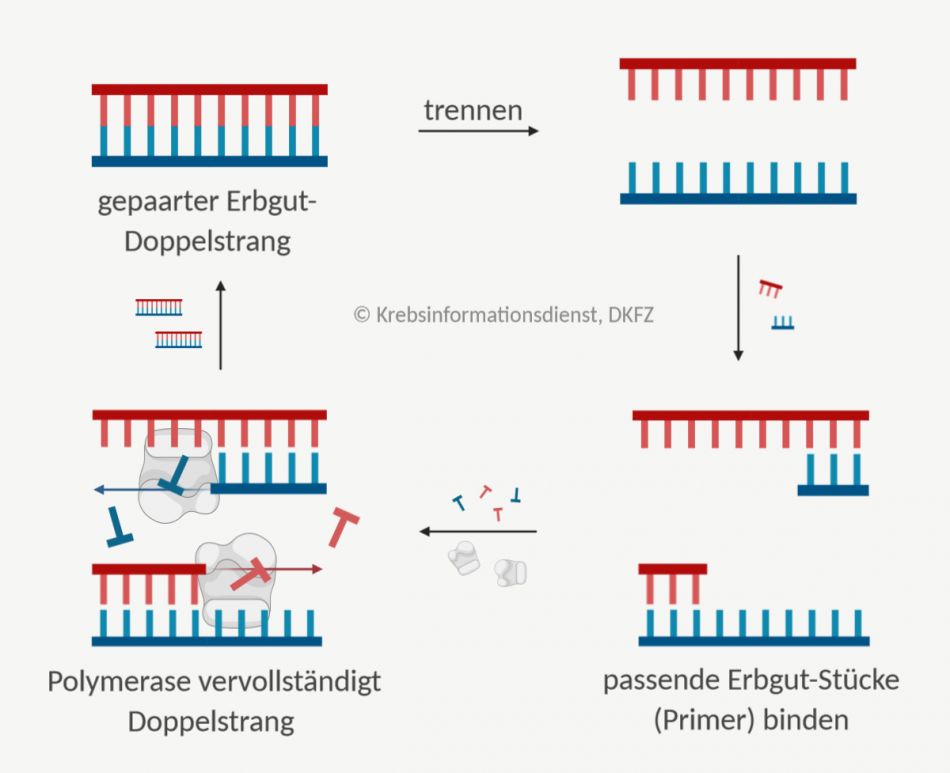
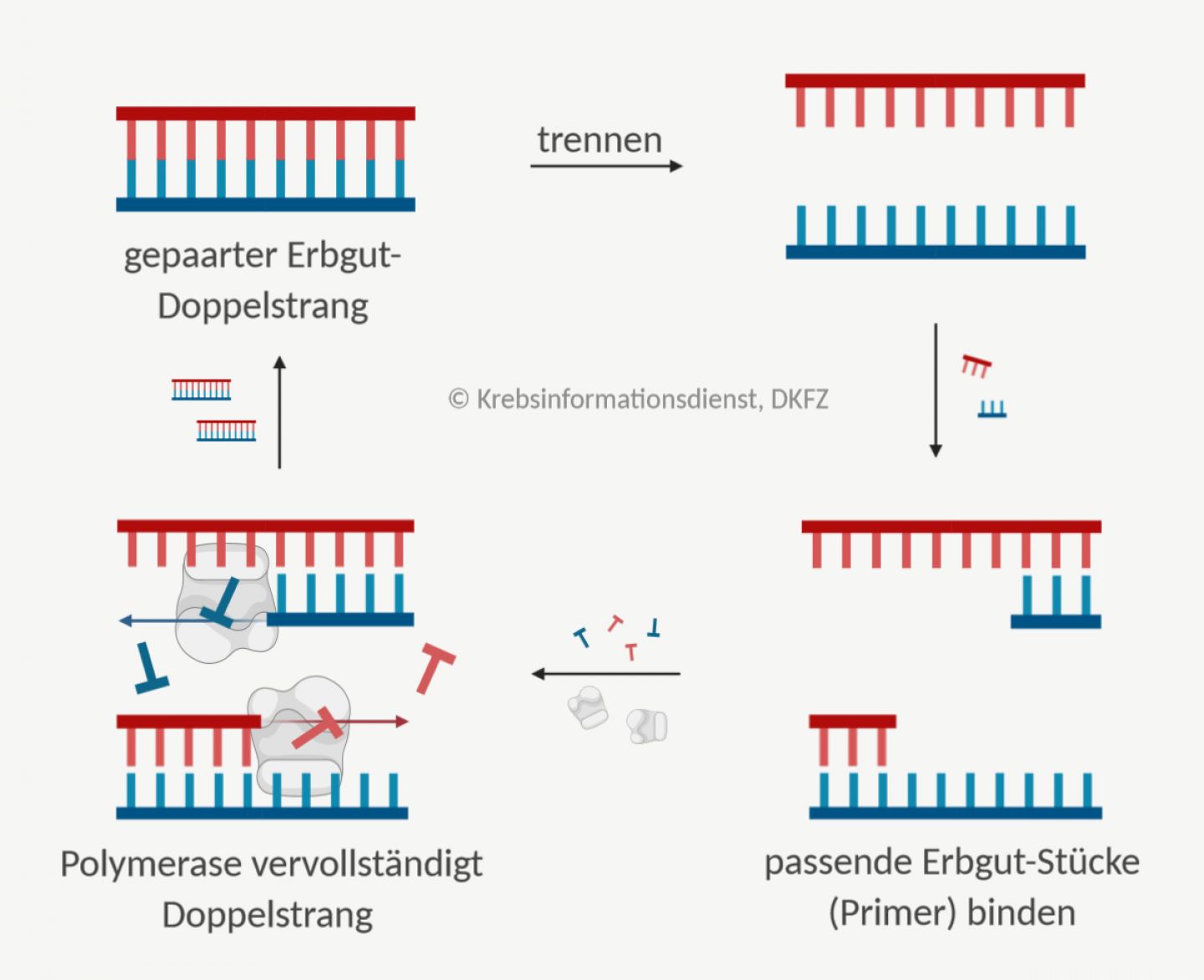
Mithilfe der sogenannten Polymerasekettenreaktion (PCR) kann man Stücke des Erbmaterials DNA vermehren. Der Abschnitt, der vervielfältigt werden soll, ist dabei genau festgelegt. Die "Polymerase" ist das Enzym, das den Erbgut-Abschnitt verlängert. Von einer "Kettenreaktion" sprechen Fachleute, weil der Prozess in einem Zyklus stattfindet, der sich ständig wiederholt.
So gewinnen Ärzte und Forscher Material für weitere Untersuchungen am Erbgut. Es lassen sich außerdem Veränderungen im Erbmaterial erkennen.
Einsatzmöglichkeiten: Die PCR wird zum Beispiel bei einem Gentest eingesetzt, um ein erbliches Krebsrisiko zu untersuchen oder die Therapie bei bestimmten Krebserkrankungen zu planen.
Mikrosatellitenanalyse
Mikrosatelliten sind kurze, sich wiederholende Stücke der Erbsubstanz DNA, die jeder Mensch besitzt. Sie sind besonders fehleranfällig bei der Zellteilung. Sind zelleigene Reparaturprozesse gestört, sammeln sich solche Fehler an: Die Länge der betroffenen DNA-Abschnitte verändert sich und wird weniger stabil. Diese "Mikrosatelliteninstabilität" (MSI) können Labormediziner mithilfe der PCR und anderer Methoden nachweisen.
Einsatzmöglichkeiten: Dieser Test dient zum Beispiel als Nachweis einer bestimmten Form von erblichem Darmkrebs. Außerdem sprechen Tumoren mit Mikrosatelliteninstabilität besser auf die Behandlung mit Immun-Checkpoint-Inhibitoren an. Deshalb kann die Analyse bei der Therapieplanung verschiedener Tumorarten zum Einsatz kommen.
Genexpressionstest: Ablese-Häufigkeit messen
Wie häufig ein bestimmter Erbgutabschnitt (ein Gen) im Zellkern abgelesen wird, bestimmt die Menge des zugehörigen Eiweißes in der Zelle. Das wirkt sich auf die Eigenschaften der Zelle aus, zum Beispiel auf Wachstum und Vermehrung.
Fachleute sprechen bei der Ablese-Häufigkeit von Genexpression. Varianten der Polymerasekettenreaktion (PCR) ermöglichen es, die Genexpression zu untersuchen.
mRNA: messenger-RNA oder Boten-RNA; diese Kopien des Erbmaterials DNA transportieren die Erbinformation aus dem Zellkern heraus und werden in Eiweiße übersetzt.
Dafür werden in den Patientenproben Kopien des Erbmaterials verwendet, die sogenannten mRNAs. Ihre Menge zeigt an, wie häufig der entsprechende Erbgutabschnitt abgelesen wird.
Einsatzmöglichkeiten: Nach diesem Prinzip funktionieren zum Beispiel Genexpressionstests für Brustkrebspatientinnen. Bei diesen und ähnlichen Tests wird die Ablese-Häufigkeit mehrerer Gene im Krebsgewebe gemessen. Deshalb spricht man auch von einer Gensignatur. Daraus kann ein Wert für das individuelle Rückfallrisiko einer Patientin ermittelt werden.
Microarray
Um die Ablese-Häufigkeit vieler Erbgutabschnitte gleichzeitig zu messen, verwenden Ärzte und Forscher sogenannte DNA-Microarrays.
An diese Glasplättchen sind viele verschiedene kleine Erbgutstücke gebunden. Trägt man eine Probe auf, dann bindet das Erbmaterial in der Probe an die entsprechenden "passenden" Erbgutstücke auf der Platte. Je häufiger ein Erbgutabschnitt in der Zelle abgelesen wird, umso mehr Erbmaterial bindet. Die Menge messen Ärzte und Forscher mithilfe von Farbstoffen.
Einsatzmöglichkeiten: Microarrays werden vor allem in der Forschung genutzt. Es gibt aber bereits erste klinische Anwendungen: Beispielsweise lässt sich damit das Rückfallrisiko von Brustkrebspatientinnen beurteilen.
Sequenzierung: Erbgut-Veränderungen im Tumor aufdecken
Sequenzieren bedeutet, das Erbgut Baustein für Baustein zu entschlüsseln und die Abfolge zu einer "Sequenz" zusammenzusetzen. Ärzte und Forscher können die Sequenz von Tumorzellen und gesunden Körperzellen miteinander vergleichen und nach Unterschieden suchen.
Es gibt verschiedene Formen der Sequenzierung, die Ärzte und Forscher je nach Fragestellung einsetzen:
- Sie können das gesamte Erbmaterial eines Patienten sequenzieren, bei einer sogenannten Tumor-Genomsequenzierung.
- Bei der Exom-Sequenzierung werden dagegen nur die Abschnitte abgelesen, die tatsächlich von der Zelle in Eiweiße übersetzt werden.
- Genpanel-Sequenzierung bedeutet, dass Ärzte nur Abschnitte sequenzieren, die bekanntermaßen bei der Entwicklung von Krebs oder von einer bestimmten Krebsart eine Rolle spielen.
- Wird ein bestimmtes Gen untersucht, dann spricht man von einem Einzel-Gentest.
Einsatzmöglichkeiten: Die Sequenzierung spielt bereits eine Rolle bei der Therapieplanung mancher Krebsarten, beispielsweise bei Lungenkrebs.
Einzelne Gene oder Gen-Panels untersuchen Ärzte zum Beispiel auch, wenn der Verdacht auf ein erbliches Krebsrisiko durch eine Veränderung in einem Gen besteht. Oder, wenn der Einsatz eines Medikamentes vom Nachweis einer bestimmten Erbgut-Veränderung abhängt.
Bisher nur in Studien untersuchen Forscher, ob Patienten einen Nutzen von der Tumor-Genomsequenzierung oder Exom-Sequenzierung haben, denen Ärzte keine etablierte Therapie (mehr) anbieten können. Dadurch finden sich unter Umständen Angriffspunkte für Medikamente, die für die Tumorart des Betroffenen bisher nicht zugelassen sind – bei anderen Tumorarten aber eine Wirkung gezeigt haben.
Forscher setzen die Sequenzierung außerdem ein, um mehr über die genetischen Veränderungen in verschiedenen Tumoren zu erfahren und neue Medikamente zu entwickeln.
Zytogenetik: Chromosomen-Veränderungen sichtbar machen
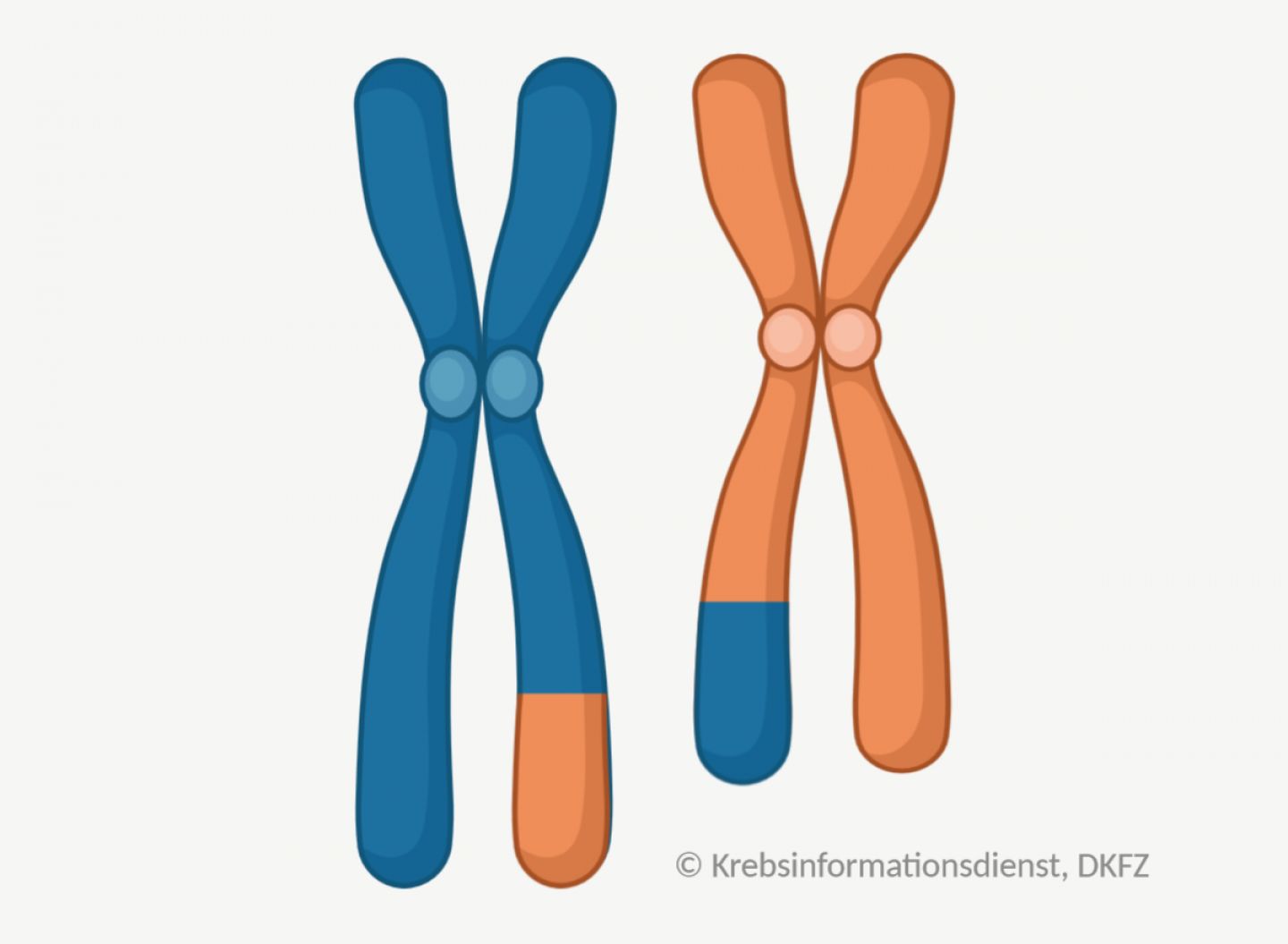
Chromosomen sind Einheiten in der Zelle, die größere Mengen an Erbinformation enthalten. Veränderungen der Zahl oder Struktur von Chromosomen können zur Krebsentstehung beitragen. Chromosomen können zum Beispiel:
- zu oft in einer Zelle vorliegen,
- Teile der Erbinformation verlieren oder
- Abschnitte untereinander austauschen.
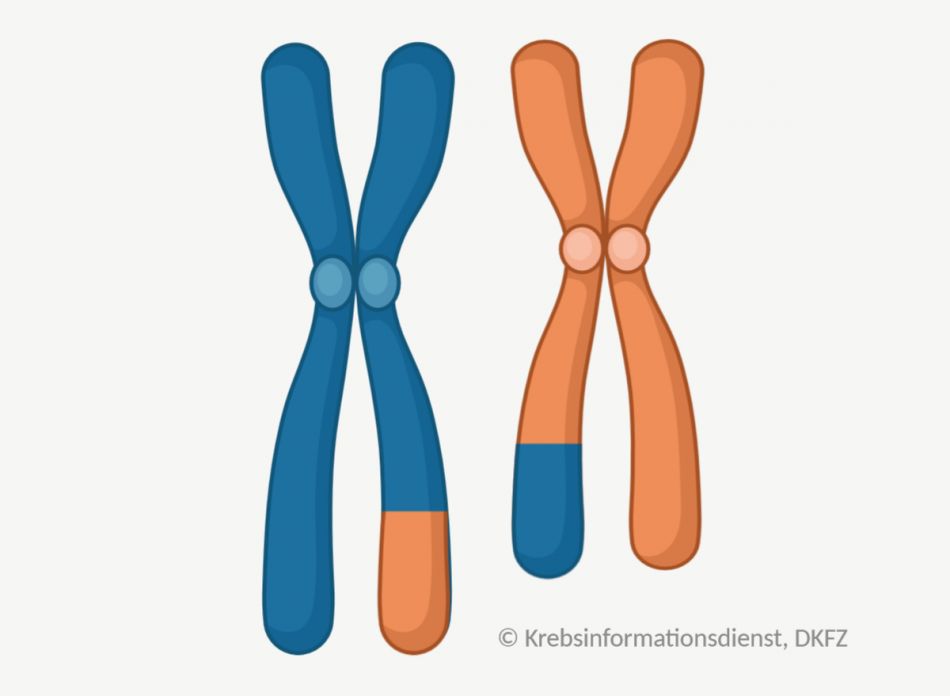
Solche größeren strukturellen Veränderungen untersuchen Labormediziner unter dem Mikroskop. Dafür färben sie die Chromosomen mit speziellen Techniken an.
Einsatzmöglichkeiten: Eine solche zytogenetische Untersuchung ist zum Beispiel wichtig, um bestimmte Unterformen einer Leukämie einzuordnen.
In-situ-Hybridisierung
Mit der In-situ-Hybridisierung können kleinere Chromosomen-Veränderungen sichtbar gemacht werden.
Bei dieser Methode bindet ein kleines Stück Erbmaterial an festgelegte Abschnitte von Chromosomen. Damit zeigt es an, ob der gesuchte Abschnitt im Chromosom vorhanden ist oder nicht (Hybridisierung = Erbgut-Bindung, in-situ = am Ort). Mit verschiedenen Farbstoffen kann die Bindung sichtbar gemacht werden – zum Beispiel mit Fluoreszenz-Farbstoffen, dann nennt sich die Technik Fluoreszenz-in-situ-Hybridisierung (FISH).
Einsatzmöglichkeiten: Die Methode setzen Ärzte zum Beispiel bei der Diagnostik einer Leukämie ein oder bei Brustkrebspatientinnen mit der Frage, ob ihre Tumorzellen den Wachstumsfaktor HER2 vermehrt herstellen.
Liquid Biopsy: Nachweis von freigesetzten Tumorzellen und Krebszell-Erbgut im Blut
Manchmal lösen sich Krebszellen von ihrem Ursprungstumor ab und schwimmen frei im Blut. Das kann bei allen möglichen Tumoren passieren, zum Beispiel bei Brustkrebs, Prostatakrebs oder Darmkrebs. Diese Zellen heißen zirkulierende Tumorzellen (CTCs, von englisch circulating tumor cells). Auch Erbmaterial von absterbenden Tumorzellen schwimmt frei im Blut.
Freie Tumorzellen und Krebszell-Erbgut im Blut zu finden, ist nicht einfach, weil beides nur in sehr kleiner Menge vorliegt und schwierig von gesunden Zellen zu unterscheiden ist. Ärzte und Forscher setzen Eiweiße gegen typische Oberflächenstrukturen ein oder filtern Zellen nach ihrer Größe. Krebszell-Erbgut erkennen sie an typischen Veränderungen.
Einsatzmöglichkeiten: Bis jetzt gibt es nur wenige Anwendungen, die Ärzte bereits bei Krebspatienten nutzen. Ein Beispiel ist der Nachweis von CTCs bei Patientinnen mit Brustkrebs. Ihre Menge gibt Hinweise auf den wahrscheinlichen Krankheitsverlauf.
Frei im Blut schwimmendes Krebszell-Erbgut untersuchen Ärzte bei manchen Lungenkrebs-Patienten. Sie können darin Veränderungen finden, die auf die Wirksamkeit von bestimmten zielgerichteten Medikamenten hinweisen.
Weitere Anwendungsmöglichkeiten werden im Moment intensiv erforscht – zum Beispiel die Frage, ob sich eine "liquid biopsy" zur Krebsfrüherkennung eignet.
Quellen und Links für Interessierte und Fachkreise
Sie haben Fragen zur molekularen Diagnostik bei Krebs? Wir sind für Sie da.
So erreichen Sie den Krebsinformationsdienst:
- am Telefon kostenlos unter 0800 – 420 30 40, täglich von 8 bis 20 Uhr
- per Mail an krebsinformationsdienst@dkfz.de (datensicheres Kontaktformular)
krebsinformationsdienst.med: Service für Fachkreise aktuell – evidenzbasiert – unabhängig
Sie haben beruflich mit molekularer Diagnostik zu tun und haben Fragen? krebsinformationsdienst.med unterstützt Sie bei Ihren Recherchen und vermittelt Informationsmaterial. Der Service steht Ihnen von Montag bis Freitag zur Verfügung:
- telefonisch von 8 bis 20 Uhr unter 0800 – 430 40 50
- per E-Mail an kid.med@dkfz.de (datensicheres Kontaktformular)
Quellen zum Weiterlesen
Informationen zu den für die Erstellung des Textes genutzten Quellen sowie nützliche Links sind in der Übersicht zum Thema Molekulare Diagnostik aufgeführt.
Weitere Themen
Erstellt: 21.01.2021
Herausgeber: Deutsches Krebsforschungszentrum (DKFZ) │ Autoren/Autorinnen: Internet-Redaktion des Krebsinformationsdienstes. Lesen Sie mehr über die Verantwortlichkeiten in der Redaktion.
Aktualität: Wir prüfen alle Inhalte regelmäßig und passen sie an, wenn sich ein Aktualisierungsbedarf durch Veröffentlichung relevanter Quellen ergibt. Lesen Sie mehr über unsere Arbeitsweise.